Rapport etter tilsyn - håndtering av blod, blodkomponenter, celler og vev 2019
Oppfølging av tilsynet
I dette tilsynet ble det ikke avdekket lovbrudd. Tilsynet er derfor avsluttet.
1. Tilsynets tema og innhold
Statens helsetilsyn fører jevnlige tilsyn med håndtering av blod, blodkomponenter, celler og vev. Tilsynet gjennomføres etter lov om statlig tilsyn med helse- og omsorgstjenesten m.m. § 1, blodforskriften § 5-1 annet ledd og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Formålet med tilsynet var å undersøke om Martina Hansens Hospital (MHH) følger opp og vedlikeholder sine etablerte systemer for å etterleve kravene som følger av forskriftene. Vi har særlig lagt vekt på sykehusets kvalitetsarbeid, tidligere tilsynsfunn og endringer etter forrige tilsyn for de aktuelle områdene.
2. Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Lovgrunnlag for tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten).
Blodforskriften og forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i aktuell forskrift.
2.2 Nærmere om sporbarhet – krav til felles europeisk kode (SEC)
Bruk av felles europeisk kode (Single European Code/SEC) er lovpålagt i hele EU-/EØS-området, og ble obligatorisk fra 29. april 2017. Koden er entydig og sikrer korrekt identifisering av donoren, sporbarhet for donert materiale og opplysninger om de viktigste egenskapene som kjennetegner det humane materialet.
Forskrift om håndtering av humane celler og vev stiller krav til at celler og vev skal tildeles en kode. I forskriftens § 40 står det at «virksomheter skal sikre at celler og vev skal kunne spores på alle trinn i håndteringsprosessen fra donor til mottaker og omvendt. Sporbarheten skal, der dette er relevant, ivaretas av felles europeisk kode (SEC)». Videre angis det i § 41 at «virksomheter, herunder virksomheter som importerer celler og vev, skal tildele alle donerte celler og vev en unik kode i henhold til felles europeisk kode (SEC) senest innen distribusjon [1] for anvendelse på mennesker», og i § 35 fjerde ledd at «Celler og vev som distribueres, skal være merket med felles europeisk kode (SEC).
2.3 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket ved gjennomgang av tilsendt dokumentasjon og innhentet skriftlig og muntlig informasjon. Tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens lokaler, utstyr og arbeid innenfor de områder tilsynet omfattet.
3. Metode, gjennomføring og deltakere ved tilsynet
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 6. februar – 27. mai 2019.
Tilsynet ble gjennomført som en kombinasjon av informasjons- og dokumentinnhenting og videomøte med involvert personell.
3.1 Metode for tilsynet
Helsetilsynet har tidligere undersøkt håndtering av blod, blodkomponenter, celler og vev ved MHH ved hjelp av tilsynsbesøk og stikkprøver. Etter en vurdering av sykehusets aktivitet og tidligere tilsynsfunn, ble det nå besluttet som tilstrekkelig å gjennomføre et dokumenttilsyn.
Valg av dokumenttilsyn som metode begrenser omfanget av tilsynet til områder der innhenting av informasjon og dokumentasjon sikrer et godt nok faktagrunnlag.
3.2 Gjennomføring av tilsynet
- Varsel om tilsyn ble sendt 6. februar 2019.
Varselbrevet inkluderte et egenrapportskjema for aktiviteter som omfattes av de to forskriftene. MHH ble bedt om å fylle ut og returnere skjemaet til Helsetilsynet sammen med etterspurte dokumenter.
- Helsetilsynet mottok de etterspurte dokumentene 25. februar 2019.
- Gjennomgang og vurdering av dokumenter
Oversikt over dokumentene Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i vedlegg 1.
Etter gjennomgang av etterspurte dokumenter besluttet Helsetilsynet å gjennomføre et videomøte med involvert personell ved MHH. Bakgrunnen for beslutningen var behov for å avklare enkelte punkter i den tilsendte dokumentasjonen.
- Videomøte med involvert personell ved MHH ble gjennomført 29. april 2019. Deltakere under videomøtet er gitt i vedlegg 2.
4. Beskrivelse av faktagrunnlaget
I dette kapittelet beskriver vi forhold ved virksomheten som er relevant for tilsynet, og faktiske forhold som ble avdekket under tilsynet.
4.1. Beskrivelse av virksomheten – spesielle forhold
Martina Hansens Hospital AS eies av stiftelsen Martina Hansens Hospital, og er et spesialsykehus i ortopedisk kirurgi, revmatologi og revmakirurgi. Sykehuset er en del av det offentlige helsetilbudet gjennom driftsavtale med Helse Sør-Øst RHF.
Blod og blodkomponenter/laboratoriet
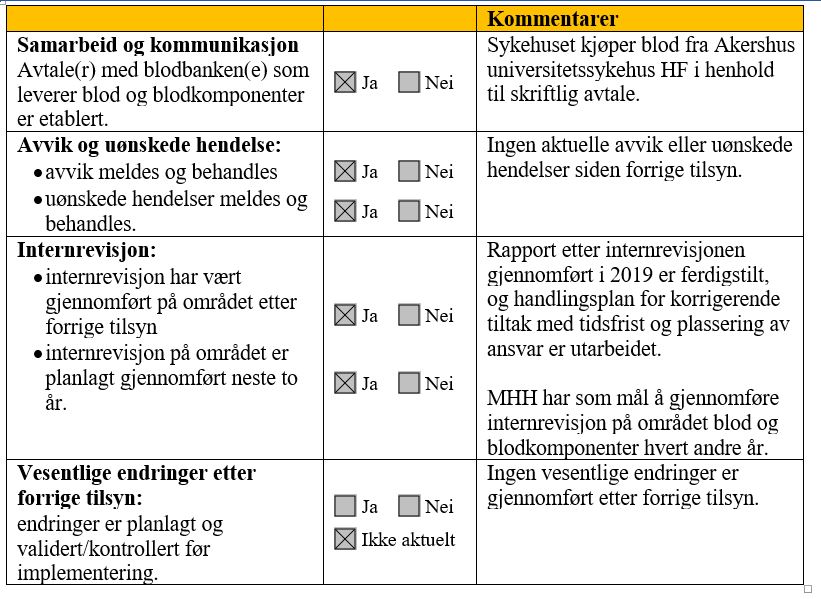
MHH har ikke egen blodbank og dekker transfusjonsbehovet til pasientene ved kjøp av blod og blodkomponenter fra Akershus universitetssykehus HF (Ahus). Sykehuset har avtale med Ahus om kjøp av blod og blodkomponenter. Kjøp, oppbevaring og utlevering av blod og blodkomponenter er lagt til laboratoriet.
Sykehuset gjennomførte i 2018 totalt 205 transfusjoner.
Celler og vev
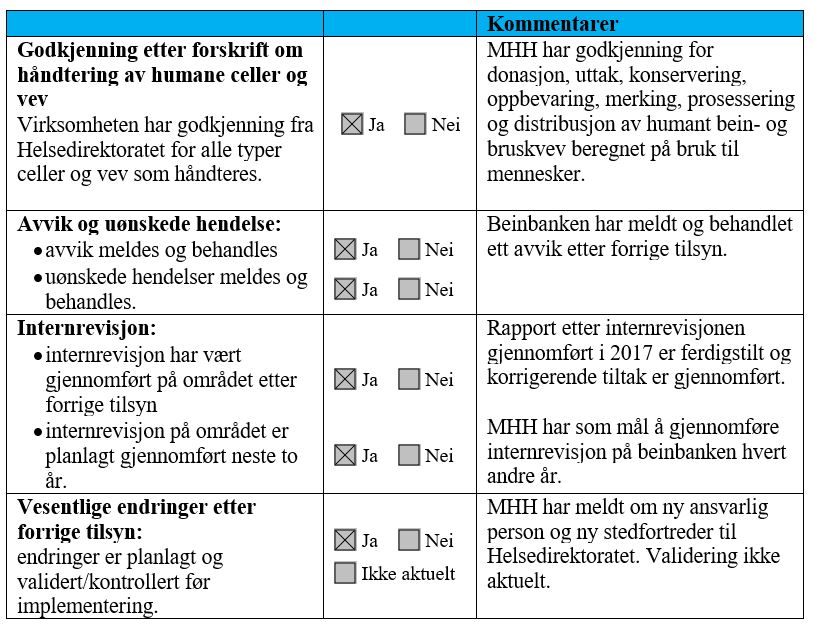
Sykehuset har opprettet beinvevsbank ved ortopedisk avdeling, og har godkjenning fra Helsedirektoratet for «donasjon, uttak, konservering, oppbevaring, merking, prosessering, og distribusjon av humant bein- og bruskvev beregnet på bruk til mennesker».
4.2. Funn etter forrige tilsyn
Blod og blodkomponenter
Helsetilsynet gjennomførte tilsyn etter blodforskriften i 2016. Tilsynet avdekket ett avvik som omhandlet identitetssikring av pasient i forbindelse med blodtransfusjon. Sykehuset utarbeidet umiddelbart en handlingsplan for korrigerende tiltak. Helsetilsynet vurderte tiltakene som tilfredsstillende og avsluttet tilsynet ved utsendelse av endelig rapport.
Celler og vev
Helsetilsynet gjennomførte tilsyn etter forskrift om håndtering av humane celler og vev i 2015. Tilsynet avdekket ikke avvik innenfor de områdene tilsynet omfattet.
4.3 Faktiske forhold som ble avdekket under tilsynet
4.3.1 Håndtering av blod og blodkomponenter
4.3.2 Håndtering av celler og vev
Andre forhold avdekket under tilsynet:
MHH har utarbeidet prosedyren «Donasjon og transplantasjon av lårbenshode, caput femoris». I prosedyren står det at «benbankboksen merkes med pasientens KODE og operasjonsdato» og at «koden følger alfabetet med 2 bokstaver, eks. FG, FH, FI». Koden skal også noteres på pasientens donasjonsskjema.
Sykehuset har godkjenning fra Helsedirektoratet for distribusjon av humant bein- og bruskvev, og har utarbeidet prosedyren «Distribusjon av humant benvev, lårbenshode/caput femoris» som beskriver fremgangsmåte ved distribusjon. Merking av humant bein- og bruskvev ved distribusjon er ikke beskrevet i prosedyren.
MHH har distribuert ett beinvev etter at krav om merking med felles europeisk kode (SEC) ble innført i april 2017.
5. Vurdering av faktagrunnlaget opp mot aktuelt lovgrunnlag
Distribusjon av humant beinvev
MHH har distribuert ett beinvev i 2019 og Helsetilsynet fikk opplyst at vevet var merket med to bokstaver og operasjonsdato. Merkingen av dette beinvevet oppfylte ikke kravet definert i forskrift om håndtering av humane celler og vev som slår fast at celler og vev til distribusjon skal kodes med felles europeisk kode (SEC).
Ledelse og kvalitetsforbedring
Helsetilsynet vurderer at ledelsen ved MHH følger opp og vedlikeholder etablerte systemer for å etterleve kravene i forskriftene ved internrevisjoner og ved håndtering av endringer, avvik og uønskede hendelser.
6. Tilsynsmyndighetens konklusjon
Tilsynet avdekket ingen avvik innen de reviderte områdene, og betraktes derfor som avsluttet.
Merknad:
Martina Hansens Hospital distribuerer sporadisk beinvev til eksterne virksomheter. Helsetilsynet legger til grunn at sykehuset endrer sin praksis for merking av beinvev ved å ta i bruk felles europeisk kode (SEC) før eventuell ny distribusjon.
Med hilsen
Brynhild Braut etter fullmakt
avdelingsdirektør
Elisabeth Try Valø
seniorrådgiver
[1] Distribusjon er definert som transport og levering av celler og vev til bruk på mennesker, jf. forskrift om håndtering av humane celler og vev § 3 bokstav i.