Rapport etter tilsyn med Helse Møre og Romsdal HF – håndtering av blod, blodkomponenter, celler og vev 2020
Oppfølging av tilsynet
I dette tilsynet ble det ikke avdekket lovbrudd. Tilsynet er derfor avsluttet.
Statens helsetilsyn har i perioden 17. februar - 1. desember 2020 gjennomført tilsyn med Helse Møre og Romsdal HF (HMR). Tilsynet omfattet håndtering av blod, blodkomponenter, celler og vev, og ble utført i henhold til følgende forskrifter:
- Forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev
Formålet med tilsynet var å undersøke om ledelsen ved HMR sikrer et høyt beskyttelsesnivå for mottakere og givere/donorer, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Tilsynet ble gjennomført ved innhenting og gjennomgang av informasjon og dokumenter. I tillegg ble det holdt videomøter med involvert personell og deres ledere. Videomøtene fant sted 12. – 16. oktober 2020.
Det ble ikke avdekket avvik innen de reviderte områdene. Tilsynet betraktes derfor som avsluttet.
1. Tilsynets tema og innhold
Statens helsetilsyn fører jevnlige tilsyn med håndtering av blod, blodkomponenter, celler og vev. Tilsynet gjennomføres etter lov om statlig tilsyn med helse- og omsorgstjenesten m.m. § 1, blodforskriften § 5-1 annet ledd og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Hensikten med tilsynet var å undersøke om ledelsen ved Helse Møre og Romsdal HF (HMR) sikrer et høyt beskyttelsesnivå for mottakere og givere/donorer, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Vi har i dette tilsynet lagt spesielt vekt på følgende:
- Håndtering av blod og blodkomponenter for transfusjon:
- hindring av sykdomsoverføring via blod og blodkomponenter, herunder utvelgelse av blodgivere
- bestilling, valg, utlevering og transport av blod og blodkomponenter
- sporbarhet - mulighet til å identifisere blod og blodkomponenter fra giver til mottaker og omvendt
- samarbeid mellom HMR og kommunehelsetjenesten ved transfusjon
- Håndtering av humane celler og vev, inkludert testing av donorer av celler og vev:
- samsvar mellom helseforetakets praksis og godkjenninger etter forskrift om håndtering av humane celler og vev
- donasjon, uttak, prosessering, konservering, oppbevaring, merking og bruk av beinvev beregnet til autolog og allogen transplantasjon i mennesker
- testing av donorer av humane celler og vev
2. Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer blod, blodkomponenter, celler og vev etterlever gjeldende lov- og forskriftsbestemmelser.
Lovgrunnlag for tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
- forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
Blodforskriften og forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
Transfusjon av blod og blodkomponenter krever samhandling mellom involvert personell ved blodbanker og/eller transfusjonsenheter og kliniske avdelinger. Kravene til sporbarhet og dokumentasjon av gjennomførte transfusjoner i pasientjournal er utdypet i blodforskriften. Oppgaver knyttet til selve transfusjonen er regulert i den generelle helselovgivningen.
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i aktuell forskrift.
2.2 Nærmere om forsvarlighet
Det er et grunnleggende krav til helsetjenesten at den helsehjelpen som ytes er faglig forsvarlig.
Kravet om forsvarlighet er en rettslig standard. Dette innebærer at innholdet bestemmes med utgangspunkt i normer utenfor loven. Disse normene er forankret i anerkjent fagkunnskap, faglige retningslinjer og samfunnsetiske normer, og utgjør det som betegnes som god praksis. Samtidig danner normene utgangspunkt for å fastlegge hvor grensen mot det uforsvarlige går.
Kravet om forsvarlighet er også et krav om forsvarlig organisering av tjenesten. I dette ligger blant annet at det gjennomføres organisatoriske og systemmessige tiltak som gjør det mulig for helsepersonellet å oppfylle plikten til forsvarlig yrkesutøvelse. Det følger av dette at virksomheten må styre sin drift med siktemål om at tjenestene er i samsvar med god praksis.
Det er en nær sammenheng mellom kravet til forsvarlighet, kravet til internkontroll og systematisk arbeid for å ivareta pasientenes sikkerhet, jf. helsetilsynsloven § 3 og forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
Nærmere om forsvarlighet ved utlevering av blod til transfusjon i kommunehelsetjenesten – norm
Blodmottakere skal være sikret forsvarlige transfusjonstjenester uavhengig av hvor de mottar behandling. Ledelsen ved virksomheter som samarbeider om å utføre transfusjoner, eksempelvis helseforetak og kommuner, skal sørge for implementerte retningslinjer og tydelig ansvars- og oppgavefordeling for alle involverte.
Når blod og blodkomponenter transfunderes utenfor spesialisthelsetjenesten skal statlige helseinstitusjoner, eller institusjoner som mottar tilskudd fra regionale helseforetak til sin virksomhet, sørge for at ansatte i spesialisthelsetjenesten settes i stand til å oppfylle plikten til å gi råd, veiledning og opplysninger om helsemessige forhold. Hensikten er at den kommunale helse- og omsorgstjenesten settes i stand til å løse sine lovpålagte oppgaver.
Etter spesialisthelsetjenesteloven § 6-3 skal helseforetaket tilby veiledning til involvert personell og etablere retningslinjer for melding av uønskede hendelser, pretransfusjonsundersøkelser, bestilling, klargjøring, pakking og transport av blod og blodkomponenter. I tillegg skal det foreligge rutiner for å sikre sporbarhet, dokumentasjon og tilbakerapportering av utførte transfusjoner.
Retningslinjer, samarbeid og informasjonsutveksling knyttet til utlevering av blod og blodkomponenter beregnet for transfusjon i kommunehelsetjenesten er ment å utgjøre sikkerhetsbarrierer for å hindre feiltransfusjoner med påfølgende pasientskade eller død.
2.3 Generelt om samarbeid ved transfusjon
Ved utlevering av blod og blodkomponenter for transfusjon i kommunehelsetjenesten stilles det strenge krav til blant annet distribusjon, utlevering, oppbevaring og dokumentasjon etter transfusjon, jf. blodforskriften §§ 3-1, 3-2 og 3-12. For å sikre at alle kravene etterleves, er det nødvendig at begge parter oppfyller sin del av forpliktelsene. Helsetilsynet vurderer at dette best kan sikres gjennom en gjensidig forpliktende avtale mellom de to partene der oppgaver og ansvar er regulert.
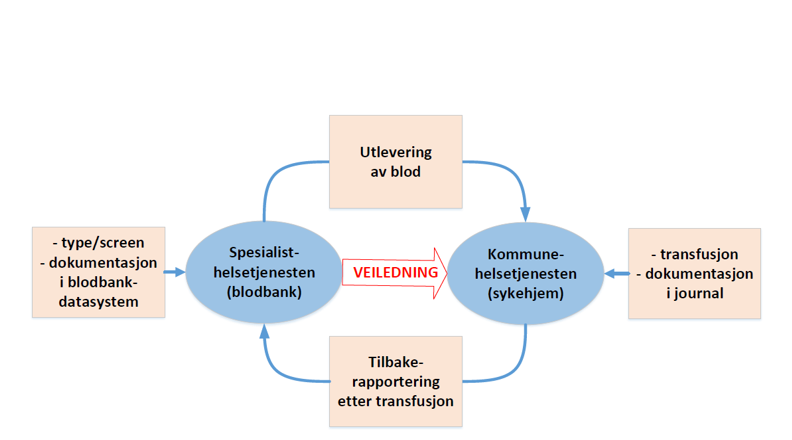
Figur 1: Samarbeid mellom spesialisthelsetjenesten og kommunehelsetjenesten ved transfusjon
Ved utlevering av blod og blodkomponenter til kommunehelsetjenesten har spesialisthelsetjenesten i tillegg en veiledningsplikt som beskrevet i kapittel 2.2.
2.4 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet.
3. Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 17. februar – 1. desember 2020.
Tilsynet ble gjennomført på følgende måte:
- Innhenting av informasjon i forkant av tilsynet.
Helsetilsynet sendte forespørsel til helseforetaket om antall utleverte enheter blod og blodkomponenter til transfusjon ved eksterne virksomheter. Informasjonen ble mottatt 21. januar 2019.
- Varsel om tilsyn ble sendt 17. februar 2020.
Varselbrevet inkluderte et egenrapportskjema for aktiviteter som omfattes av de to forskriftene. HMR ble bedt om å fylle ut og returnere skjemaet til Helsetilsynet sammen med etterspurte dokumenter.
I varselbrevet informerte Helsetilsynet om at gjennomføring av tilsynet var planlagt på følgende måte:
-
- Tilsyn med håndtering av blod og blodkomponenter var planlagt gjennomført ved en kombinasjon av informasjons- og dokumentinnhenting, intervju av involvert personell og befaring ved blodbankene i Kristiansund og Ålesund.
- Tilsyn med håndtering av humant beinvev var planlagt gjennomført ved en kombinasjon av informasjons- og dokumentinnhenting, og tilsynsbesøk ved beinbankene i Kristiansund og Ålesund.
- Tilsyn med smittettesting av donorer av celler og vev var i utgangspunktet planlagt gjennomført ved informasjons- og dokumentinnhenting. Etter gjennomgang av etterspurte dokumenter ville Helsetilsynet vurdere om tilsynet skulle inkludere tilsynsbesøk også for dette området.
Statens legemiddelverk skulle gjennomføre tilsyn med blodbankvirksomheten i HMR i samme periode. I varselbrevet ble det informert om at de to tilsynsetatene ville samarbeide om den praktiske gjennomføringen, og at det ville være felles åpnings- og sluttmøte.
- Gjennomgang og vurdering av dokumenter
Oversikt over dokumenter Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i vedlegg 1.
- Endring i gjennomføring av tilsynet.
Etter en vurdering av smittesituasjonen i forbindelse med utbrudd av covid-19, ble det besluttet at gjennomføring av tilsynet skulle endres. Tilsynsbesøket ville bli erstattet med innhenting og gjennomgang av ytterligere dokumenter og digitale møter og intervjuer.
Endringen medførte at samarbeidet om den praktiske gjennomføringen av tilsynsbesøket mellom Legemiddelverket og Helsetilsynet ikke ville la seg gjennomføre slik det opprinnelig var planlagt. De to etatene ville derfor ha hver sine åpnings- og sluttmøter.
- Tilsynets videomøter ble gjennomført 12. – 16. oktober 2020. Program for videomøtene er gitt i vedlegg 2. Videomøtene omfattet:
- åpningsmøte
- intervju med involvert personell og deres ledere ved blodbankene i Kristiansund og Ålesund
- intervju med involvert personell og deres ledere ved beinbankene i Kristiansund og Ålesund
- presentasjon av helseforetakets oppfølging av egen transfusjonspraksis ved helseforetakets ledelse
- sluttmøte med presentasjon av Helsetilsynets funn.
For smittetesting av donorer av ble tilsynet gjennomført ved informasjons- og dokumentinnhenting som opprinnelig planlagt.
3.2 Deltakere
Deltakere fra HMR:
- Kontaktperson fra virksomheten: kvalitetssjef Vidar Hagerup
- For oversikt over andre deltakere viser vi til vedlegg 3.
Deltakere fra Helsetilsynet:
- seniorrådgiver Elisabeth Try Valø (revisjonsleder)
- fagsjef Tone Blørstad (revisor)
- seniorrådgiver Tone Andersen (revisor)
- rådgiver Monica Jenssen Nybruket (revisor)
4. Relevante forhold ved virksomheten
HMR har rundt 6400 ansatte og leverer tjenester til i overkant av 265000 innbyggere i Møre og Romsdal. Helseforetakets virksomhet er fordelt mellom sykehusene i Ålesund, Volda, Molde og Kristiansund, samt flere mindre institusjoner.
Helseforetaket har blodbankvirksomhet ved alle fire sykehusene. Aktiviteten er organisert under avdeling for medisinsk biokjemi, klinikk for diagnostikk. Transfusjon av blod foregår ved de kliniske avdelingene i helseforetaket. I tillegg leverer blodbankene i Ålesund og Kristiansund ut blod for transfusjon i kommunehelsetjenesten.
HMR har fire godkjenninger fra Helsedirektoratet etter forskrift om håndtering av humane celler og vev. Aktiviteten foregår ved tre ulike klinikker:
- Beinbanken i Ålesund, ortopedisk avdeling Ålesund, klinikk for kirurgi har godkjenning som omfatter «donasjon, uttak, prosessering, konservering, oppbevaring og merking av beinvev beregnet på allogen transplantasjon til mennesker».
- Beinbanken i Kristiansund, operasjon Kristiansund, klinikk for akuttmedisin
har godkjenning som omfatter «donasjon, uttak, konservering, oppbevaring, merking og bruk av beinvev beregnet til autolog og allogen transplantasjon i mennesker».
- Mikrobiologi Ålesund, avdeling for medisinsk mikrobiologi, klinikk for diagnostikk har godkjenning som omfatter «testing av donorer av celler og vev».
- Mikrobiologi Molde, avdeling for medisinsk mikrobiologi, klinikk for diagnostikk har godkjenning som omfatter «testing av donorer av celler og vev».
5. Håndtering av blod og blodkomponenter
5.1 Utvelgelse av blodgivere
Utvelgelse av blodgivere er et viktig ledd for å hindre overføring av sykdom fra giver til mottaker via blod og blodkomponenter. Helsetilsynet har merket seg følgende:
- Prosedyren «Mottak og intervju av blodgivere» beskriver blant annet «karantener pga. utenlandsopphold» og spesifiserer karantenetid for utvalgte sykdommer. Prosedyren er oppdatert for «SARS-CoV-2 (koronavirus) og blodgivning».
- Helseforetaket har innført elektronisk blodgiverskjema som skal fylles ut av blodgivere og deretter gjennomgås under blodgiverintervjuet. Helseforetaket har lagt til et eget spørsmål i skjemaet som omhandler Covid-19.
- Prosedyren «Mottak og intervju av blodgivere» påpeker rutiner «slik at giveren føler seg trygg på at samtalen er konfidensiell». Involvert personell opplyste under intervju at konfidensialitet under blodgiversamtalen var viktig.
5.2 Samarbeid med kommunehelsetjenesten ved transfusjon
Helsetilsynet har undersøkt hvordan HMR samarbeider med kommunehelsetjenesten ved transfusjon, inkludert bestilling, valg, utlevering og transport av blod og blodkomponenter. I tillegg har Helsetilsynet undersøkt hvordan sporbarhet mellom giver og mottaker ivaretas ved utlevering av blod og blodkomponenter til kommunehelsetjenesten, herunder tilbakerapportering etter transfusjon. Helsetilsynet har merket seg følgende:
- Helseforetaket har inngått «Avtale om blodtransfusjon utenfor sykehus» med alle aktuelle virksomheter. Avtalen beskriver ansvarsfordeling mellom HMR og kommunehelsetjenesten.
- I avtalen er det presisert at involvert personell i kommunehelsetjenesten skal «sette seg inn i og følge prosedyren: Transfusjon av blodkomponenter i primærhelsetjenesten, EQS id: 14020, og gjennomføre e-læring: «Transfusjon av blodprodukt for primærhelsetenesta». Opplæringen skal kunne dokumenteres.»
- Palliativt team ved helseforetaket har undervist personell i kommunehelsetjenesten som transfunderer blod.
- HMR har utarbeidet «sjekkliste ved transport og oppfølging av blodkomponenter». Blodbanken bruker sjekklisten for oppfølging ved transfusjon utenfor eget sykehus. Sjekklisten inkluderer tilbakerapportering fra kommunehelsetjeneste etter transfusjon og dokumentasjon av gjennomført transfusjon i blodbankdatasystemet.
5.3 Helseforetakets oppfølging av egen transfusjonspraksis
Etter tilsyn i 2017 avdekket Helsetilsynet et avvik som omhandlet mangelfull identitetskontroll ved blodtransfusjon. Etter tilsynet har HMR fulgt opp egen transfusjonspraksis på følgende måte:
- Internrevisjoner med transfusjon av blod som tema er gjennomført.
- Avvik relatert til transfusjon overvåkes og viser nedgang i antall avvik meldt på dette området.
- Opplæring av leger og sykepleiere i transfusjon skal dokumenteres i kompetanseportalen. Dokumentasjonen overvåkes og følges opp med mål om at flere ansatte skal gjennomføre opplæringen.
- Blodbanken i Ålesund har gjennomført undervisning på fagdag med transfusjon som tema.
5.4 Ledelse og kvalitetsforbedring
- Helseforetaket har godkjenning fra Helsedirektoratet for blodbankvirksomhet ved alle fire sykehusene
- Tiltak etter utbrudd av covid-19 var innført for å hindre smitte, eksempelvis adgangskontroll inn til sykehusene, bruk av håndsprit, avstand og spritvask eller bruk av engangspapir på tappestolenes armlener. Risiko- og sårbarhetsanalyse (ROS-analyse) var gjennomført.
- HMR har tatt i bruk elektronisk kompetanseportal for bruk til dokumentasjon av opplæringsplaner og gjennomført opplæring.
- Avdeling for medisinsk biokjemi har felles prosedyrer som gjelder for alle blodbankene når dette er hensiktsmessig. Innføring av nye felles prosedyrer vurderes fortløpende.
- Avvik blir diskutert i ulike fora for forbedring på tvers av blodbankene og på tvers av klinikker når dette er relevant.
- Internrevisjoner med håndtering av blod og blodkomponenter som tema gjennomføres jevnlig.
6. Håndtering av humane celler og vev
6.1 Generelt inntrykk
- HMR har godkjenning for aktuell håndtering av humane celler og vev.
- Interne revisjoner som omhandler håndtering av humane celler og gjennomføres etter overordnet prosedyre og revisjonsplan.
- Helseforetaket har elektronisk avvikssystem og rutiner for å melde avvik og hendelser.
6.2 Håndtering av humant beinvev
6.2.1 Rutiner og praksis
Beinbankene i Kristiansund og Ålesund høster et lavt antall bein til bruk i egen avdeling. Helsetilsynet har merket seg følgende:
- Beinbankene sikrer sporbarhet ved dokumentasjon i manuelle systemer.
- De to beinbankene har ulike rutiner for merking av bein:
- I Kristiansund merkes bein med navn, fødselsnummer og «dagens dato»
- I Ålesund merkes bein med løpenummer/årstall, operasjonsdato og «Ålesund sjukehus»
Merkerutinene forutsetter at beinet kun brukes internt på det sykehuset beinbanken tilhører.
- Vask og vedlikehold av beinbankfrysere blir utført og dokumentert.
- Beinbankfryserne er koblet til ekstern temperaturalarm.
6.2.2 Ledelse og kvalitetsforbedring:
- HMR har anskaffet elektronisk kompetanseportal som er tatt i bruk av beinbanken i Kristiansund. Ved beinbanken i Ålesund ble opplæring dokumentert ved signatur på papir.
- Sykepleiere som intervjuer donorer og operasjonssykepleiere som håndterer beinvev var lært opp ved undervisning og gjennomgang av prosedyrer i EQS. De to beinbankene samarbeider ikke om undervisningen, og hadde utarbeidet undervisningsmateriell i varierende grad.
- Helseforetaket gjennomfører internrevisjon ved beinbankene hvert andre år. Internrevisjonene omhandler praksis, dokumentasjon og gjennomgang av prosedyrer og lovverk.
6.3 Smittetesting av donorer av celler og vev
- Tilsynsbesøk ble gjennomført ved laboratoriene i Ålesund og Molde ved forrige tilsyn (2017).
- Det ble ikke avdekket avvik relatert til smittetesting av donorer av celler og vev ved forrige tilsyn.
- Ansvarlig person etter forskrift om håndtering av humane celler og vev er ikke endret etter forrige tilsyn.
- Avvik meldes og håndteres ved laboratoriene.
- Internrevisjon er gjennomført for området siste to år.
- Plan for internrevisjon neste to år er utarbeidet og inkluderer smittetesting av donorer av celler og vev.
Innhentede dokumenter ga ikke grunnlag for å gjennomføre tilsynsbesøk i 2020.
7. Helsetilsynets vurdering og konklusjon
Dette tilsynet omhandlet håndtering av blod, blodkomponenter, celler og vev ved Helse Møre og Romsdal HF. Tilsynet ble gjennomført ved innhenting og gjennomgang av informasjon og dokumenter. I tillegg ble det holdt videomøter med intervju av involvert personell og deres ledere.
Helsetilsynet har undersøkt og vurdert forholdene ved helseforetaket jf. beskrivelse i kapittel 5 og 6. Undersøkelsene er utført med de begrensninger videomøter gir.
Helsetilsynets konklusjon er at det ikke er funnet grunnlag for avvik innen de reviderte områdene.
Med hilsen
Mona Kaasa etter fullmakt
fung. avdelingsdirektør
Elisabeth Try Valø
seniorrådgiver
Brevet er godkjent elektronisk og sendes derfor uten underskrift
Saksbehandler: seniorrådgiver Elisabeth Try Valø, tlf.21 52 99 83
Kopi til:
Helsedirektoratet
Statens legemiddelverk
Fylkesmannen i Møre og Romsdal
Vidar Hagerup, kvalitetssjef HMR
Vedlegg:
- Dokumentunderlag
- Program for tilsynets videomøter
- Deltakere under tilsynets videomøter