Rapport etter tilsyn – håndtering av blod, blodkomponenter, celler og vev ved Sykehuset Telemark HF 2019
Oppfølging av tilsynet
Ved dette tilsynet ble det avdekt lovbrudd. Tilsynsmyndigheten har vurdert de tiltakene som er satt i verk som tilstrekkelige. Tilsynet er derfor avsluttet.
Statens helsetilsyn har i perioden 7. juni-26. september 2019 gjennomført tilsyn ved Sykehuset Telemark HF. Tilsynet omfattet håndtering av blod, blodkomponenter, celler og vev og ble utført i henhold til følgende forskrifter:
- Forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev
Formålet med tilsynet var å undersøke om ledelsen ved Sykehuset Telemark sikrer et høyt beskyttelsesnivå for mottakere og givere/donorer, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Tilsynet ble gjennomført som en kombinasjon av informasjons- og dokumentinnhenting, og tilsynsbesøk med stikkprøver, dokumentgjennomgang og intervju av involvert personell og deres ledere.
Tilsynsbesøket fant sted i Notodden og Porsgrunn 28. august og i Skien 29. august 2019.
Tilsynet avdekket ett avvik:
Sykehuset Telemark har distribuert humant bein uten å ha retningslinjer og nødvendig godkjenning for denne aktiviteten. Mangelfulle rutiner for merking av beinvev, distribusjon og transport kan føre til redusert kvalitet og manglende sporbarhet for beinvev.
1. Tilsynets tema og innhold
Statens helsetilsyn fører jevnlige tilsyn med håndtering av blod, blodkomponenter, celler og vev. Tilsynet gjennomføres etter lov om statlig tilsyn med helse- og omsorgstjenesten m.m. § 1, blodforskriften § 5-1 annet ledd og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Formålet med tilsynet var å undersøke om ledelsen ved Sykehuset Telemark sikrer et høyt beskyttelsesnivå for mottakere og givere/donorer, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Vi har lagt spesielt vekt på følgende:
- hindring av sykdomsoverføring via blod og blodkomponenter, herunder utvelgelse av blodgivere
- bestilling, valg, utlevering og transport av blod og blodkomponenter
- sporbarhet – mulighet for å identifisere blod og blodkomponenter fra giver til mottaker og omvendt, herunder identitetssikring
- samarbeid mellom Sykehuset Telemark og kommunehelsetjenesten ved transfusjon
- håndtering av humane celler og vev, inkludert smittetesting av donorer av celler og vev.
2. Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer blod, blodkomponenter, celler og vev etterlever gjeldende lov- og forskriftsbestemmelser.
Lovgrunnlag for tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven)
- forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten).
Blodforskriften og forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i aktuell forskrift.
2.2 Nærmere om internkontroll
Internkontroll skal bidra til faglig forsvarlige helsetjenester, og er et verktøy som skal sikre at daglige arbeidsoppgaver blir organisert, utført, styrt og forbedret i henhold til lovens krav. Helseforetaket skal således gjennom sin internkontroll tilrettelegge sine tjenester slik at personell som utfører tjenester blir i stand til å overholde sine lovpålagte plikter. Helseforetaket skal blant annet skaffe oversikt over områder i virksomheten hvor det er fare for svikt og utvikle, iverksette, kontrollere, evaluere og forbedre nødvendige prosedyrer, instrukser, rutiner eller andre tiltak for å avdekke, rette opp og forebygge overtredelse av helselovgivningen.
2.3 Nærmere om forsvarlighet
Det er et grunnleggende krav til helsetjenesten at den helsehjelpen som ytes er faglig forsvarlig.
Kravet om forsvarlighet er en rettslig standard. Dette innebærer at innholdet bestemmes med utgangspunkt i normer utenfor loven. Disse normene er forankret i anerkjent fagkunnskap, faglige retningslinjer og samfunnsetiske normer, og utgjør det som betegnes som god praksis. Samtidig danner normene utgangspunkt for å fastlegge hvor grensen mot det uforsvarlige går.
Kravet om forsvarlighet er også et krav om forsvarlig organisering av tjenesten. I dette ligger blant annet at det gjennomføres organisatoriske og systemmessige tiltak som gjør det mulig for helsepersonellet å oppfylle plikten til forsvarlig yrkesutøvelse. Det følger av dette at virksomheten må styre sin drift med siktemål om at tjenestene er i samsvar med god praksis.
Det er en nær sammenheng mellom kravet til forsvarlighet, kravet til internkontroll og systematisk arbeid for å ivareta pasientenes sikkerhet, jf. helsetilsynsloven § 3 og forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten.
2.4 Nærmere om sporbarhet ved distribusjon av humane celler og vev – krav til felles europeisk kode (SEC)
Bruk av felles europeisk kode (Single European Code/SEC) ved distribusjon av humane celler og vev er lovpålagt i hele EU-/EØS-området, og ble obligatorisk fra 29. april 2017. Koden er entydig og sikrer korrekt identifisering av donoren, sporbarhet for donert materiale og opplysninger om de viktigste egenskapene som kjennetegner det humane materialet.
Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev stiller krav til at celler og vev skal tildeles en kode. I forskriftens § 40 står det at «virksomheter skal sikre at celler og vev skal kunne spores på alle trinn i håndteringsprosessen fra donor til mottaker og omvendt. Sporbarheten skal, der dette er relevant, ivaretas av felles europeisk kode (SEC)». Videre angis det i § 41 at «virksomheter, herunder virksomheter som importerer celler og vev, skal tildele alle donerte celler og vev en unik kode i henhold til felles europeisk kode (SEC) senest innen distribusjon for anvendelse på mennesker».
2.5 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Klassifisering av avvik:
- Kritisk avvik (K): Avvik som utgjør en signifikant risiko for skade på donor eller mottaker av blod, celler, vev og/eller organer.
- Stort avvik (S): Ikke kritisk avvik som utgjør en indirekte risiko for sikkerheten til donor og mottaker av blod, celler, vev og og/eller organer ved:
- avvik fra gjeldende myndighetskrav for håndtering av blod, celler, vev og/eller organer
- svikt i prosedyrene for frigivelse av blod, celler, vev og/eller organer til bruk på mennesker, eller at ansvarlig person ikke har utført sine legale plikter
- manglende godkjenning fra Helsedirektoratet for aktuell aktivitet
En kombinasjon av flere mindre mangler som hver for seg ikke utgjør et stort avvik, men som til sammen utgjør et stort avvik, skal rapporteres som det.
- Andre avvik (A): Avvik som ikke kan klassifiseres som kritisk eller stort, men som innebærer manglende samsvar med kravene til god praksis som følger av forskriftene for håndtering av blod, celler, vev og/eller organer.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet.
3 Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 7. juni- 26. september 2019.
Tilsynet ble gjennomført som en kombinasjon av informasjons- og dokumentinnhenting, tilsynsbesøk med stikkprøver, dokumentgjennomgang og intervju av involvert personell og deres ledere.
- Innhenting av informasjon i forkant av tilsynet.
Helsetilsynet sendte i 2018 forespørsel til helseforetaket om antall utleverte enheter blod og blodkomponenter til transfusjon ved eksterne virksomheter. Informasjonen ble mottatt fra helseforetaket 28. november 2018.
- Varsel om tilsyn ble sendt 7. juni 2019.
Varselbrevet inkluderte et egenrapportskjema for aktiviteter som omfattes av de to forskriftene. Sykehuset Telemark ble bedt om å fylle ut og returnere skjemaet til Helsetilsynet sammen med etterspurte dokumenter.
I varselbrevet informerte Helsetilsynet om at det ville bli gjennomført tilsynsbesøk ved blodbankvirksomheten, og at det for området celler og vev i utgangspunktet var planlagt kun dokumenttilsyn. Etter gjennomgang av etterspurte dokumenter ville Helsetilsynet vurdere om det også skulle gjennomføres tilsynsbesøk for celler og vev.
- Gjennomgang og vurdering av dokumenter
Oversikt over dokumenter Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i vedlegg 1.
Etter gjennomgang av etterspurte dokumenter besluttet Helsetilsynet å gjennomføre tilsynsbesøk ved Fertilitetsavdelingen Sør og ved Beinbanken. Bakgrunnen for beslutningen var behov for å undersøke nærmere noen utvalgte temaer ved avdelingene.
For området smittetesting av donorer av celler og vev ble tilsynet gjennomført som dokumenttilsyn.
- Tilsynsbesøk ble gjennomført 28. og 29. august 2019. Program for tilsynsbesøket er gitt i vedlegg 2.
Åpningsmøtet ble gjennomført på Notodden sykehus 28. august 2019 og sluttmøtet ble gjennomført på Sykehuset Telemark, Skien 29. august 2019. Helseforetakets ledelse og involvert personell deltok på møtene. I tillegg deltok administrerende direktør på sluttmøtet. Ledere og involvert personell fra Sykehuset Telemark, Skien deltok på åpningsmøtet via videooverføring, og ledere og involvert personell fra Notodden sykehus deltok over telefon på sluttmøtet.
Tilsynsbesøket omfattet intervjuer av involvert personell, dokumentgjennomgang og befaring. Det ble gjennomført tilsynsbesøk ved følgende seksjoner/avdelinger:- Seksjon for medisinsk biokjemi og blodbank, Notodden
- Seksjon for medisinsk biokjemi II og blodbank, Skien
- Fertilitetsavdelingen Sør, Porsgrunn
- Beinbanken, seksjon for ortopedi, Skien
3.2 Deltakere
Deltakere fra Sykehuset Telemark:
- Kontaktperson fra virksomheten: kvalitetssikringsleder Inger Hagen Seland
- For oversikt over andre deltakere viser vi til vedlegg 3.
Deltakere fra Helsetilsynet:
- seniorrådgiver Elisabeth Try Valø (revisjonsleder)
- fagsjef Tone Blørstad (revisor)
4 Beskrivelse av faktagrunnlaget
I dette kapittelet beskriver vi forhold ved virksomheten som var relevant for tilsynet, og faktiske forhold som ble avdekket under tilsynet.
4.1 Beskrivelse av virksomheten – spesielle forhold
Sykehuset Telemark HF har hovedsete i Skien og behandlingssteder for somatikk og psykiatri på Notodden og i Porsgrunn, Kragerø og Rjukan. Helseforetaket tilbyr i tillegg psykiatrisk behandling i Seljord og behandling for sykelig overvekt på Nordagutu. Helseforetaket er organisert med syv sykehusovergripende klinikker direkte underlagt administrerende direktør.
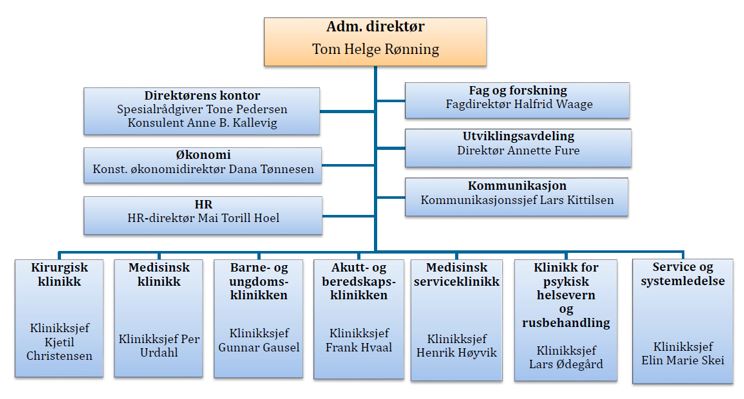
Sykehuset Telemark HF har blodbankvirksomhet i Skien og på Notodden, og tappestasjoner i Porsgrunn, Kragerø og på Rjukan. Virksomheten er organisert i avdeling for laboratoriemedisin (ALM) under medisinsk serviceklinikk. Sykehuset Telemark HF har godkjenning fra Helsedirektoratet etter blodforskriften for denne aktiviteten.
Helseforetaket har også tre godkjenninger etter forskrift om kvalitet og sikkerhet ved håndtering av humane celler og vev. Aktivitetene er organisert under kirurgisk klinikk og medisinsk serviceklinikk. Utvelgelse av beindonorer, donasjon og håndtering av beinvev foregår ved avdeling for endo/mamma, ortopedi og gastrokirurgi, organisert under kirurgisk klinikk. Håndtering av egg, sæd og embryo beregnet for assistert befruktning foregår ved Fertilitetsavdelingen Sør, og smittetesting av donorer av celler og vev utføres ved avdeling for laboratoriemedisin. De to avdelingene tilhører medisinsk serviceklinikk.
4.2 Faktiske forhold som ble avdekket under tilsynet
4.2.1. Håndtering av blod og blodkomponenter
Ved innhenting av informasjon fra helseforetaket i forkant av tilsynsbesøket ble det klart at helseforetaket ikke utleverer blod og blodkomponenter for transfusjon i kommunehelsetjenesten. Samarbeid mellom Sykehuset Telemark og kommunehelsetjenesten om transfusjon er derfor ikke omtalt.
Hindring av sykdomsoverføring via blod og blodkomponenter, herunder utvelgelse av blodgivere
- Sykehuset Telemark har utarbeidet rutiner og retningslinjer for registrering, innkalling og intervju av nye og etablerte blodgivere.
- Utfylling av blodgiverskjema og intervju av blodgivere foregår i egnede rom som legger til rette for fortrolighet. Taushetsbelagt informasjon var ikke tilgjengelig for uvedkommende.
- Helseforetaket følger systematisk opp at involvert personell gjøres kjent med endringer i reisekarantene for blodgivere.
- Blodbankansvarlig lege var tilgjengelig ved eventuelle spørsmål fra involvert personell ved blodbankene.
Bestilling, valg, utlevering og transport av blod og blodkomponenter
- Blodbanken har tatt i bruk elektronisk kontroll av blod mot pasientidentifikasjon ved utlevering av blod og blodkomponenter. Alle som henter blod på blodbanken har dokumentert opplæring i bruk av det elektroniske systemet.
- Ved transport av fullblod fra tappestasjoner til blodbank blir blodet pakket i transportkasser validert for dette formålet.
- Temperaturen i transportkassene måles og logges kontinuerlig under transport av blod.
Ledelse og kvalitetsforbedring
- Avdeling for laboratoriemedisin har utarbeidet prosedyre for endringskontroll med tilhørende endringskontrollskjema. Helsetilsynet ble forevist dokumentasjon som viste at endringskontroll blir gjennomført i praksis.
- Blodbankene har utarbeidet egne opplæringsprosedyrer med tilhørende sjekklister.
- Helseforetaket planlegger for å kunne tilby transfusjon i kommunehelsetjenesten. Prosedyrer, opplæringsrutiner og avtale med kommunene er under utarbeiding. Planleggingen gjennomføres i samarbeid med samhandlingskoordinatorer i aktuelle kommuner.
- Ansatte ved blodbanken er kjent med og benytter helseforetakets avvikssystem. Meldte avvik håndteres systematisk.
- Helseforetaket gjennomfører systematisk internrevisjon etter oppsatte planer.
4.2.2. Håndtering av humane celler og vev, inkludert smittetesting av donorer av celler og vev
Humant beinvev
Ut fra innhentet informasjon i forkant av tilsynsbesøket, ble tema ved besøket begrenset til å omhandle endringer siden forrige tilsyn og distribusjon av humant beinvev.
Beinbanken distribuerte i mars 2019 syv caput (lårbenshoder) til en beinbank under et annet helseforetak, og tilsynet avdekket følgende:
- Sykehuset Telemark har ikke godkjenning fra Helsedirektoratet for distribusjon av celler og vev.
- Helseforetaket har inngått en skriftlig avtale med mottakende virksomhet. Avtalen lister opp krav ved utvelgelse av donor, nødvendige laboratorieundersøkelser og tidspunkt for uttak av blodprøver fra levende donor. Avtalen regulerer ikke forskriftens krav til oppgave- og ansvarfordeling, eksempelvis bestilling, transport, sporbarhet, tilbakekall og rapportering av relevante opplysninger.
- Helseforetaket har ikke utarbeidet skriftlig prosedyre som beskriver kriteriene for å gjennomføre distribusjon av beinvev.
- Distribuert caput var ikke merket med Single European Code (SEC) slik forskriften krever. Helseforetaket har i ettertid utarbeidet retningslinjen «Beinbank koder – skjema» som inneholder en mal for koding med SEC.
- Beinbanken har vært kjent med at caput har vært distribuert uten tilfredsstillende merking, men har ikke registrert og behandlet dette i helseforetakets avvikssystem.
- Helseforetaket gjennomfører ikke systematisk internrevisjon ved beinbanken, men beinbanken har gjennomgått deler av aktiviteten i forbindelse med årsrapportering.
Egg, sæd og embryo beregnet for assistert befruktning
Ut fra innhentet informasjon i forkant av tilsynsbesøket, ble tema ved besøket begrenset til å omhandle ID-kontroll, samtykke gjennom et behandlingsforløp og endringer siden forrige tilsyn. Helsetilsynet har merket seg følgende:
- Fertilitetsavdelingen Sør gjennomfører dokumentert ID-kontroll av begge partene i paret før fertilitetsbehandling. Gyldig legitimasjon må forevises. Senere i behandlingsforløpet må partene oppgi navn og fødselsnummer.
- Bilder av paret lagres i avdelingens interne datasystem etter skriftlig samtykke. Bildene benyttes for ytterligere bekreftelse av identitet gjennom behandlingsforløpet.
- Elektronisk registrering av personopplysninger skjer etter skriftlig samtykke.
- Bygningsmessige endringer har blitt utført for å redusere skade på innholdet i fertilitetsavdelingens frysetanker ved en eventuell brann. Kartlegging av risiko ved selve ombyggingen ble utført i forkant, og risikoreduserende tiltak iverksatt.
- Internt registrerte avvik, tilsynsfunn og hendelser ved andre virksomheter blir gjennomgått systematisk og brukt til læring og forbedring.
- Avdelingen har utarbeidet skriftlige prosedyrer i helseforetakets dokumentstyringssystem.
- Avdelingen har utarbeidet en rullerende plan for internrevisjon.
Smittetesting av donorer av celler og vev
Innhentede opplysninger i forbindelse med tilsynet ga ikke grunnlag for å gjennomføre tilsynsbesøk. Konklusjonen bygger på følgende:
- Helsetilsynet avdekket ikke avvik ved forrige tilsyn (2015).
- Laboratoriet har ikke gjennomgått vesentlige endringer siden forrige tilsyn.
- Avdeling for laboratoriemedisin registrerer og håndtere avvik i helseforetakets avvikssystem, men har ikke registret avvik relatert til smittetesting av donorer av celler og vev siste to år.
- Helseforetaket gjennomfører systematisk internrevisjon ved avdelingen, og smittetesting av donorer er inkludert i revisjonsplanen for 2019.
Vi har også merket oss at Helseforetaket opplyser om smittetesting av donorer av celler og vev på sine nettsider.
5. Vurdering av faktagrunnlaget opp mot aktuelt lovgrunnlag
Overføring av blod, celler og vev har en iboende risiko for å påføre sykdom til givere/donorer og mottakere. Myndighetene stiller derfor strenge krav til virksomheter som håndterer blod, blodkomponenter, celler og vev, inkludert smittetesting av donorer og blodgivere. Virksomhetene er pålagt å etterleve kravene for å sikre at kvalitet og sikkerhet på det humane materialet opprettholdes, og for hindre at givere/donorer og mottakere blir påført sykdom og skade. Når virksomhetene tilhører et helseforetak, har ledelsen ved helseforetaket et overordnet ansvar for at pasientsikkerheten ivaretas ved transfusjon og transplantasjon.
Vi har i dette kapittelet vurdert de faktiske forholdene som ble avdekket under tilsynet.
5.1 Håndtering av blod og blodkomponenter
Helsetilsynet vurderer at avdeling for laboratoriemedisin har utarbeidet og oppdaterer retningslinjer for utvelgelse av blodgivere, og for bestilling, valg, utlevering og transport av blod og blodkomponenter i tråd med gjeldende regelverk.
Forsvarlig praksis ved utvelgelse av blodgivere er av avgjørende betydning for at det skal være trygt både å gi og å motta blod og blodkomponenter. Vi har særlig merket oss at helseforetaket arbeider målrettet med å harmonisere rutinene ved de to blodbankene med tilhørende tappestasjoner, og at alle enheter har tilgang til lege ved behov for medisinskfaglige råd.
5.2 Håndtering av humane celler og vev, inkludert smittetesting av donorer av celler og vev
Sykehuset Telemark håndterer beinvev og egg, sæd og embryo beregnet for assistert befruktning, og utfører pålagte smittetester for donorer av celler og vev. Helseforetaket har utpekt ansvarlig person for hvert av områdene. Aktivitetene er ikke samordnet, og vi har her valgt å vurdere hvert fagområde for seg.
Beinvev
Helseforetaket har i utgangspunktet etablert en beinbank for donasjon, uttak, oppbevaring og transplantasjon til egne pasienter. Tilsynet avdekket at beinbanken i ett tilfelle hadde valgt å distribuere beinvev til en ekstern virksomhet. Helsetilsynet fikk opplyst at beslutningen om distribusjon ble tatt ut fra hensynet til pasienter med behov for transplantasjon av beinvev. Helsetilsynet har ikke funnet grunnlag for at distribusjon av bein i dette tilfellet har medført økt risiko for pasientene ved den eksterne virksomheten. Vi finner imidlertid at manglende rutiner, retningslinjer og avtaler for distribusjon kan gi økt risiko for feil og hendelser som kan få konsekvenser ved gjentatt distribusjon. Helsetilsynet vil særlig påpeke at unik merking av beinvev før distribusjon er avgjørende for å sikre sporbarhet og redusere faren for forbytting.
Egg, sæd og embryo beregnet for transplantasjon
Etter Helsetilsynets vurdering har Fertilitetsavdelingen Sør rutiner og retningslinjer i tråd med gjeldende regelverk for ID-kontroll og samtykke ved fertilitetsbehandling.
Helsetilsynet vil bemerke at avdelingen viste at alvorlige hendelser ved andre virksomheter blir gjennomgått med tanke på læring og forbedring internt. Etter vår vurdering kan systematisk arbeid med avvik og hendelser og kartlegging av risiko føre til forbedring og økt pasientsikkerhet.
Smittetesting av donorer
Avdeling for laboratoriemedisin har gjennom tidligere tilsyn vist at rutiner og retningslinjer for smittetesting av donorer blir fulgt jevnlig opp. Ut fra innhentet dokumentasjon ved dette tilsynet anser Helsetilsynet at Sykehuset Telemark opprettholder sine systemer efor smittetesting av donorer.
5.3 Ledelse og kvalitetsforbedring
Ledelsen ved Sykehuset Telemark har overordnet ansvar for pasientsikkerheten ved bruk og distribusjon av humant materiale, og for at alle involverte kjenner og etterlever kravene til kvalitet og sikkerhet som følger av lov og forskrift.
Sykehuset Telemark har både ved dette tilsynet og tidligere vist at ledelsen følger opp egen aktivitet ved hjelp av blant annet internrevisjoner, ledelsens gjennomgang og avviksrapporter. Dette tilsynet viste varierende kjennskap til, og etterlevelse av myndighetskravene ved de ulike avdelingene. Etter Helsetilsynets vurdering viser forholdene som ble avdekket at jevnlig og systematisk gjennomgang er særlig viktig ved endringer. Vi vil påpeke at helseforetakets ledelse har et særlig ansvar for å følge opp ansatte med nye og/eller endrede oppgaver slik at pasientsikkerheten ved bruk av humant materiale blir ivaretatt uavhengig av enkeltpersoner.
6. Tilsynets konklusjon
Tilsynet avdekket ett avvik.
Avvik:
Sykehuset Telemark har distribuert humant bein uten å ha retningslinjer og nødvendig godkjenning for denne aktiviteten. Mangelfulle rutiner for merking av beinvev, distribusjon og transport kan føre til redusert kvalitet og manglende sporbarhet for beinvev. (A)
Avvik fra følgende krav i forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev:
§ 4 Godkjenning og vilkår
§ 8 Internkontroll mv.
§ 9 Avtaler med tredjepart
§ 35 Distribusjon
§ 38 Merking
§ 40 Sporbarhet
§ 41 Felles europeisk kode (SEC)
§ 42 Tilbakekall
§ 43 Rapportering av relevante opplysninger
7. Oppfølging av påpekte avvik
Helseforetakets ledelse har ansvaret for å iverksette og følge opp korrigerende tiltak etter tilsynet.
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 12. desember 2019:
- helseforetakets handlingsplan for korrigerende tiltak
- beskrivelse av hvordan ledelsen ved Sykehuset Telemark skal følge opp at iverksatte tiltak fungerer etter hensikten.