Rapport etter tilsyn med Helse Bergen HF – håndtering av celler og vev 2022
Oppfølging av tilsynet
Ved dette tilsynet ble det avdekt lovbrudd. Kontakt etaten som har utført tilsynet for status på avviket.
Statens helsetilsyn har i perioden 22. august 2022 – 6. mars 2023 gjennomført tilsyn med Helse Bergen HF. Tilsynet omfattet håndtering av celler og vev og ble utført i henhold til følgende forskrift:
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (FOR-2015-12-07-1430)
Hensikten med tilsynet var å undersøke om ledelsen ved Helse Bergen sikrer et høyt beskyttelsesnivå for donorer og mottakere, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på celler og vev.
Tilsynet ble gjennomført ved en kombinasjon av informasjonsinnhenting, dokumentgjennomgang og tilsynsbesøk med stikkprøver og intervju av involvert personell og deres ledere. Tilsynsbesøket fant sted 18. – 21. oktober 2022.
Tilsynet avdekket ett avvik:
Ledelsen ved Helse Bergen HF har mangelfull oversikt over humane celler og vev som benyttes i pasientbehandlingen. Helseforetaket håndterer bindevevshinner uten å sikre at gjeldene regelverk etterleves, og uten godkjenning for denne aktiviteten.
Helseforetaket sikrer heller ikke at vesentlige endringer og årsrapporter blir sendt inn for alle områdene. Mangelfull oppfølging fra ledelsen kan ha medført redusert pasientsikkerhet ved donasjon og mottak av humane celler og vev
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 9. juni 2023:
- helseforetakets handlingsplan for korrigerende tiltak
- beskrivelse av hvordan Helse Bergen skal følge opp at iverksatte tiltak fungerer etter hensikten
Dokumentasjonen sendes til: med kopi til
1. Tilsynets tema og omfang
Statens helsetilsyn fører jevnlige tilsyn med håndtering av celler og vev. Tilsynet gjennomføres etter helsetilsynsloven § 4 og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Hensikten med tilsynet var å undersøke om ledelsen ved Helse Bergen sikrer et høyt beskyttelsesnivå for donorer og mottakere, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på celler og vev.
Vi har i dette tilsynet lagt hovedvekt på følgende:
- samsvar mellom helseforetakets praksis og godkjenninger etter forskrift om håndtering av humane celler og vev
- oppfølging etter forrige tilsyn
- håndtering av humane celler og vev ved aktuelle avdelinger/klinikker
Tilsynet omfattet følgende områder:
- hematopoetiske stamceller
- hudceller og hudvev
- egg, sæd og embryo beregnet på assistert befruktning
- hornhinner og øyevev
- bein- og senevev
- kraniebein til autolog bruk1
- smittetesting av donorer av celler og vev
2. Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer celler og vev etterlever gjeldende lov- og forskriftsbestemmelser.
Regelverk som i hovedsak er lagt til grunn ved tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
Forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
Forskrift om håndtering av humane celler og vev er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i forskriften.
2.2 Nærmere om forsvarlighet
Det er et grunnleggende krav til helsetjenesten at den helsehjelpen som ytes er faglig forsvarlig.
Kravet om forsvarlighet er en rettslig standard. Dette innebærer at innholdet bestemmes med utgangspunkt i normer utenfor loven. Disse normene er forankret i anerkjent fagkunnskap, faglige retningslinjer og samfunnsetiske normer, og utgjør det som betegnes som god praksis. Samtidig danner normene utgangspunkt for å fastlegge hvor grensen mot det uforsvarlige går.
Kravet om forsvarlighet er også et krav om forsvarlig organisering av tjenesten. I dette ligger blant annet at det gjennomføres organisatoriske og systemmessige tiltak som gjør det mulig for helsepersonellet å oppfylle plikten til forsvarlig yrkesutøvelse. Det følger av dette at virksomheten må styre sin drift med siktemål om at tjenestene er i samsvar med god praksis.
Det er en nær sammenheng mellom kravet til forsvarlighet, kravet til internkontroll og systematisk arbeid for å ivareta pasientenes sikkerhet, jf. helsetilsynsloven § 3 og forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
2.3 Nærmere om krav til godkjenning
Håndtering av humane celler og vev beregnet til anvendelse på mennesker kan bare finne sted ved virksomheter som er godkjent av Helsedirektoratet. Helsedirektoratet kan knytte vilkår til godkjenningene og avgjør blant annet hvilke aktiviteter og framstillingsprosedyrer virksomheter som håndterer humane celler og vev kan utføre.
Helseforetak som eier virksomheter som håndterer celler og vev har ansvaret for at nødvendige godkjenninger etter forskrift om håndtering av humane celler og vev foreligger, og for å skaffe seg nødvendige godkjenninger etter bioteknologiloven der dette er aktuelt. Helseforetaket har også ansvar for at årsrapporter og vesentlige endringer, inkludert endringer i ansvarlig person, blir sendt inn til Helsedirektoratet.
2.4 Nærmere om luftkvalitet på IVF-laboratorier
Forskrift om håndtering av humane celler og vev stiller krav om luftkvalitet tilsvarende GMP klasse A når «celler og vev eksponeres for omgivelsene». Mindre strenge krav til luftkvalitet godtas dersom klasse A er «skadelig for egenskapene til de berørte celler og vev». Håndtering av egg, sæd og embryo faller inn under dette unntaket. Ved unntak må kompenserende tiltak på IVF-laboratoriet settes i verk for å redusere antall mikroorganismer og partikler mest mulig. Luftkvaliteten skal spesifiseres, monitoreres og kontrolleres jevnlig ved måling av partikler og mikroorganismer (CFU).
Eshre2 har i «Revised guidelines for good practice in IVF laboratories (2015)» bl.a. beskrevet hvordan et IVF-laboratorium bør innrettes for å sikre tilfredsstillende luftkvalitet. Helsetilsynet har lagt guidelinen til grunn ved utdyping av mulige tiltak for å redusere antall mikroorganismer og partikler på laboratoriet. Punktene under gir et sammendrag av det Helsetilsynet anser som mest relevant:
- materialer som benyttes på IVF-laboratoriet bør ha renromsstandard
- laboratorieluften bør være koplet til HEPA-filter
- overtrykk på laboratoriet anbefales for å minimere luftforurensning
- system for ren adgang til laboratoriet for personell og materialer anbefales sterkt
- det bør tilrettelegges for klesskift og håndvask utenfor laboratoriet
- separate kontorlokaler for administrativt arbeid bør være tilgjengelig utenfor laboratoriet
- utstyr på laboratoriet må være lett å desinfisere og holdes rent for å unngå kontaminering
For fullstendig tekst viser vi til «Revised guidelines for good practice in IVF laboratories (2015)».
2.5 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Klassifisering av avvik:
- Kritisk avvik (K): Avvik som utgjør en signifikant risiko for skade på donor eller mottaker av blod, celler, vev og/eller organer.
- Stort avvik (S): Ikke kritisk avvik som utgjør en indirekte risiko for sikkerheten til donor og mottaker av blod, celler, vev og og/eller organer ved
- avvik fra gjeldende myndighetskrav for håndtering av blod, celler, vev og/eller organer
- svikt i prosedyrene for frigivelse av blod, celler, vev og/eller organer til bruk på mennesker, eller at ansvarlig person ikke har utført sine legale plikter
- manglende godkjenning fra Helsedirektoratet for aktuell aktivitet
En kombinasjon av flere mindre mangler som hver for seg ikke utgjør et stort avvik, men som til sammen utgjør et stort avvik, skal rapporteres som det.
- Andre avvik (A): Avvik som ikke kan klassifiseres som kritisk eller stort, men som innebærer manglende samsvar med kravene til god praksis som følger av forskriftene for håndtering av blod, celler, vev og/eller organer.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet.
3. Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 22. august 2022 – 6. mars 2023.
For beskrivelse av hvordan tilsynet ble gjennomført og program for tilsynsbesøket viser vi til vedlegg 1 og 3.
3.2 Deltakere under tilsynsbesøket
Deltakere fra Helse Bergen:
- Kontaktperson fra virksomheten: spesialrådgiver Pål Farsund
- For oversikt over andre deltakere viser vi til vedlegg 4.
Deltakere fra Helsetilsynet:
- seniorrådgiver Elisabeth Try Valø (revisjonsleder)
- seniorrådgiver Tone Andersen (revisor)
- seniorrådgiver Kristine Bjerkaas-Kjeldal (revisor)
- rådgiver Tonje Stegavik (observatør)
4. Kort om virksomheten
Helse Bergen HF administrerer sykehus og institusjoner i Vestland fylke. Størstedelen av virksomheten forgår på Haukeland universitetssjukehus i Bergen, Kysthospitalet i Hagevik og Voss sjukehus.
Helse Bergen har åtte godkjenninger fra Helsedirektoratet for håndtering av humane celler og vev beregnet for bruk på mennesker, inkludert smittetesting av donorer av celler og vev. Aktiviteten foregår på Haukeland og Kysthospitalet i Hagevik og er organisert under seks ulike klinikker:
- Kirurgisk klinikk:
- håndtering av humane hudceller og hudvev ved enhet for brannskade, avdeling for plastikk-, hånd- og rekonstruktiv kirurgi og Nasjonalt brannskadesenter
- Kvinneklinikken:
- håndtering av egg, sæd og embryo beregnet for assistert befruktning ved enhet for assistert befruktning, gynekologisk avdeling
- Laboratorieklinikken:
- håndtering av hematopoetiske stamceller ved avdeling for immunologi og transfusjonsmedisin
- smittetesting donorer av celler og vev ved mikrobiologisk avdeling
- Nevroklinikken:
- håndtering av kraniebein til autolog bruk ved nevrokirurgisk avdeling
- Ortopedisk klinikk:
- håndtering av humant bein- og senevev ved beinbanken, ortopedisk avdeling, Haukeland
- håndtering av humant beinvev ved beinbanken, Kysthospitalet i Hagevik
- Øyeavdelingen:
- håndtering av hornhinner og øyevev ved hornhinnebanken, seksjon cornea.
5. Beskrivelse av faktagrunnlaget
5.1 Samsvar mellom helseforetakets praksis og godkjenninger etter forskrift om håndtering av humane celler og vev
Håndtering av humane celler og vev beregnet til anvendelse på mennesker kan bare finne sted etter godkjenning fra Helsedirektoratet. Under tilsynet ble helseforetaket bedt om å undersøke om de håndterer celler og vev uten at godkjenning er gitt. Informasjonen mottatt i utfylt egenrapportskjema ble fulgt opp under tilsynsbesøket.
Tilsynet avdekket at helseforetaket håndterer bindevevshinner (sene facia lata) for autolog bruk ved øyeavdelingen. Aktiviteten utføres uten godkjenning fra Helsedirektoratet. Helse Bergen har godkjenning for håndtering av hornhinner og øyevev ved øyeavdelingens hornhinnebank. Håndtering av bindevevshinner er adskilt fra hornhinnebanken, og utføres av annet personell.
Involvert personell informerte om at bindevevshinner blir tatt ut fra pasientens hoftekam, pakkes inn i dobbel plastpose som plasseres i en egen eske og oppbevares i fryser sammen med annet humant materiale på avdelingen. Hinnene blir senere transplantert til samme pasient for rekonstruksjon ved ansiktslammelser.
Under tilsynsbesøket ble det fortalt at bindevevshinner som oppbevares i fryser ikke var merket med «til autolog bruk». På sluttmøtet ble Helsetilsynet informert om at dette var rettet opp, og at bindevevshinnene i fryseren nå er merket med pasientens navn og «til autolog bruk».
5.2 Oppfølging etter forrige tilsyn
Forrige tilsyn (2017) viste at Helse Bergen hadde forbedringsområder knyttet til anskaffelse, mottak og oppbevaring av amnionhinne, beinvev, kraniebein og hudvev. Undersøkelser ved dette tilsynet (2022) viste at Helse Bergen har korrigert egen praksis, og Helsetilsynet har blant annet merket seg at celler og vev nå blir oppbevart i kalibrert og temperaturovervåket utstyr ved alle aktuelle avdelinger i helseforetaket.
5.3 Hematopoetiske stamceller
Helse Bergen har godkjenning for «donasjon, uttak, konservering, oppbevaring, merking, prosessering og distribusjon av humane hematopoietiske stamceller (inkludert lymfocytt infusjon) beregnet til autolog og allogen transplantasjon3 til mennesker» ved avdeling for immunologi og transfusjonsmedisin, heretter AIT.
Involvert personell ved AIT fortalte under tilsynsbesøket at avdelingen tar ut hematopoetiske stamceller for autolog bruk, og i noen tilfeller fra donor beslektet med mottaker (allogen bruk). Stamcellene blir i hovedsak høstet fra perifert blod, men avdelingen har også høstet fra benmarg. Ved sjeldne tilfeller har stamceller fra beslektet donor blitt høstet ved en annen virksomhet for senere transplantasjon ved Helse Bergen. Årsrapporter fra siste to år viser at det i denne perioden bare er høstet stamceller fra perifert blod, og at stamceller fra beslektet donor ikke er mottatt fra andre virksomheter.
Uttak og bruk av hematopoetiske stamceller gjennomføres ved et samarbeid mellom AIT og medisinsk avdeling. Mottatt dokumentasjon viser at rutiner, ansvar og oppgavefordeling mellom de to avdelingene er regulert gjennom samhandlingsavtalen «Samhandling mellom Seksjon for celleterapi og Seksjon for blodsykdommer om autolog og allogen stamcelletransplantasjon».
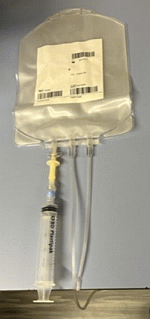 Vi ble fortalt at stamcellene tilsettes en fryseløsning (DMSO) via et lukket system i LAF-benk før de fryses ned (se figur 1 til høyre: Lukket system for stamceller). Avdelingen utfører halvårlig partikkelmåling i LAF-benk og rom, og kontrollerer at dette tilfredsstiller luftkvalitet klasse A. Helsetilsynet har mottatt dokumentasjon som viser at partikkeltelling er utført 15.august 2022 av et eksternt firma. Innfrysning av cellene gjøres ved et validert program i en innfrysningsmaskin beregnet for dette. Etter innfrysning oppbevares stamcellene i flytende nitrogen (-196ºC).
Vi ble fortalt at stamcellene tilsettes en fryseløsning (DMSO) via et lukket system i LAF-benk før de fryses ned (se figur 1 til høyre: Lukket system for stamceller). Avdelingen utfører halvårlig partikkelmåling i LAF-benk og rom, og kontrollerer at dette tilfredsstiller luftkvalitet klasse A. Helsetilsynet har mottatt dokumentasjon som viser at partikkeltelling er utført 15.august 2022 av et eksternt firma. Innfrysning av cellene gjøres ved et validert program i en innfrysningsmaskin beregnet for dette. Etter innfrysning oppbevares stamcellene i flytende nitrogen (-196ºC).
Avdelingen har lagt til rette for at også pasienter med påvist smitte kan få behandling med autologe stamceller. I slike tilfeller benyttes en egen nitrogentank til oppbevaring av stamcellene.
Under tilsynet fikk Helsetilsynet i tillegg opplyst følgende:
- Obligatoriske smittetester blir utført på autologe og allogene donorer ved uttak og seks måneder etter uttak.
- Kritisk utstyr blir vedlikeholdt etter oppsatt plan. Helsetilsynet ble vist dokumentasjon på utført ukentlig vedlikehold samt siste servicerapport fra leverandør.
- Aferesesett (posesett for høsting av stamceller fra perifert blod) og tilsetningsløsninger blir oppbevart i romtemperatur som angitt fra leverandør. Temperaturen blir loggført.
- Dokumentasjon av sporbarhet mellom donor og mottaker blir ivaretatt i helseforetakets blodbankdatasystem.
- Skriftlige rutiner og retningslinjer er utarbeidet og blir vedlikeholdt i helseforetakets elektroniske kvalitetshåndbok.
- AIT har utarbeidet dokumentet «kvalitetshåndbok – Seksjon for celleterapi» som gir en oversikt over aktuelle dokumenter og prosedyrer ved håndtering av hematopoetiske stamceller.
- Opplæring og vedlikehold av kompetanse blir planlagt og dokumentert i helseforetakets kompetanseportal. Det ble informert om at personalet øver på prosedyrer som utøves sjeldent, deriblant høsting av benmarg. Også dette dokumenteres i kompetanseportalen.
- Avvik registreres og behandles i helseforetakets elektroniske avvikssystem. Mottatt oversikt viser at avvik er meldt for området siste to år. AIT opplyste at avvik blir fulgt opp og brukes ved forbedringsarbeid i seksjonen.
- Mottatt dokumentasjon viser at etterspurt årsrapport var sendt til Helsedirektoratet.
- AIT har gjennomført internrevisjoner som omhandler håndtering av celler og vev siste to år. To revisjonsrapporter ble forevist under tilsynsbesøket. Avdelingen har egen revisjonsplan for håndtering av celler og vev, og Helsetilsynet har mottatt planen for perioden 2022 – 2026.
5.4 Hudceller og hudvev
Helse Bergen har godkjenning fra Helsedirektoratet for «donasjon, uttak, konservering, oppbevaring, koding, merking og distribusjon av humane hudceller og hudvev beregnet til autolog og allogen transplantasjon til mennesker» ved avdeling for plastikkirurgi og brannskade, heretter brannskadeavdelingen.
 Brannskadeavdelingen anskaffer hud fra en virksomhet i Nederland. Avdelingen har inngått en skriftlig avtale med leverandøren, og gjennomgang av avtalen viste at kravene i EU-direktiv 2004/23/EC er inkludert.
Brannskadeavdelingen anskaffer hud fra en virksomhet i Nederland. Avdelingen har inngått en skriftlig avtale med leverandøren, og gjennomgang av avtalen viste at kravene i EU-direktiv 2004/23/EC er inkludert.
Dokumentasjon fremlagt under tilsynsbesøket viste at brannskadeavdelingen utfører mottakskontroll som bl.a. inkluderer kontroll av obligatoriske smittetester. Videre ble Helsetilsynet fortalt at rørene med hud blir oppbevart uåpnet i kjøleskap til de skal brukes til transplantasjon, og at rørene først blir åpnet inne på operasjonsstua (se figur 2 til høyre: Rør med hudvev)
Under tilsynet fikk Helsetilsynet i tillegg opplyst følgende:
- Dokumentasjon av sporbarhet mellom donor og mottaker blir ivaretatt ved manuell registrering på ark som oppbevares i perm sammen med leverandørens følgedokumenter. Merkelapper med donorkode blir klistret på et ark med pasientopplysninger, og deretter skannet inn i pasientens journal. Rapporter på benyttet hud blir sendt månedlig til leverandøren.
- Skriftlige rutiner og retningslinjer er utarbeidet og blir vedlikeholdt i helseforetakets elektroniske kvalitetshåndbok.
- Helsetilsynet har fått opplysninger om at opplæring gjennomføres, men den blir ikke dokumentert i helseforetakets kompetanseportal. Brannskadeavdelingen har en årlig fagdag med bl.a. gjennomgang av prosedyrer.
- Avvik registreres og behandles i helseforetakets elektroniske avvikssystem. Mottatt oversikt viser at ett avvik er meldt for området siste to år, og gjennomgang av dokumentasjon viste at avviket var håndtert og lukket. AIT opplyste at avvik blir tatt opp på personalmøter.
- Mottatt dokumentasjon viser at etterspurt årsrapport var sendt til Helsedirektoratet.
- Brannskadeavdelingen gjennomfører jevnlig en opptelling av allograft (hudvev) i kjøleskapet, og allograft utgått på dato blir kassert.
5.5 Egg, sæd og embryo beregnet for assistert befruktning
Helse Bergen har godkjenning fra Helsedirektoratet for «donasjon, uttak, konservering, oppbevaring, koding, merking, bearbeiding og distribusjon av humane celler og vev beregnet til bruk ved assistert befruktning hos mennesker» ved enhet for assistert befruktning, gynekologisk avdeling, heretter EAB.
EAB tilbyr assistert befruktning ved partnerdonasjon. Behandlingene som tilbys er godkjent av Helsedirektoratet etter bioteknologiloven og omfatter kirurgisk uthenting av sæd fra testikkel, prøverørsbehandling, befruktning ved hjelp av mikroinjeksjon, vitrifisering og oppbevaring av ubefruktede egg på medisinsk indikasjon.
Helsetilsynet ble fortalt at henvisninger til assistert befruktning blir gjennomgått av lege ved seksjonen som sørger for at time til utredning blir avtalt. Samtykkeskjema blir signert og lagret i pasientens journal ved uttak og ved tilbakeføring av embryo. Stikkprøver under tilsynsbesøket viste at behandlingsforløpet, gjennomført identitetskontroll av paret underveis i behandlingsforløpet og bekreftelse på mottatt samtykkeskjema var dokumentert i fagdatasystemet. Det foreligger rutine for innhenting av barne- og omsorgsattest for paret.
EAB opplyste under tilsynsbesøket at dersom behandlingen blir flyttet til en annen klinikk i Norge etter oppstart, vil sæd bli merket med Singel European Code (SEC-kode) og oppbevart i gassfasen i en transportbeholder med flytende nitrogen under transport.
Luftkvaliteten på IVF-laboratoriet skal kontrolleres «jamleg og helst minst 1 gang i året» som beskrevet i prosedyren «Kontroll av luftkvalitet». Mottatt dokumentasjon viste at partikler ble sist målt i LAF-benken i desember 2021 i tilknytning til årlig service fra leverandøren, og på IVF-laboratoriet i 2017. Mikroorganismer (CFU) i LAF-benk og på laboratoriet ble sist målt i november 2021. Resultater av målinger forevist under tilsynsbesøket og var innenfor krav satt av enheten om luftkvalitet klasse D.
Befaring på laboratoriet viste at skåler som benyttes på laboratoriet var merket med kvinnens navn, behandlingsnummer og dato for inkuberingsstart som beskrevet i prosedyren «Generelle identifiserings- og merkingsrutiner». Befaringen viste også at laboratoriet fremstod som maksimalt utnyttet, noe uryddig og med unødvendige papirer og gjenstander liggende framme.
Under tilsynet fikk Helsetilsynet i tillegg opplyst følgende:
- Blodprøver til obligatoriske smittetester rekvireres elektronisk ved en «donorpakke» i DIPS.
- Skriftlige rutiner og retningslinjer er utarbeidet og blir vedlikeholdt i helseforetakets elektroniske kvalitetshåndbok. Ansatte får muntlig beskjed ved endringer i prosedyrer.
- Opplæring og vedlikehold av kompetanse blir planlagt og dokumentert i helseforetakets kompetanseportal. Gjennomgang av forskrift om håndtering av humane celler og vev er lagt inn som årlig oppgave i kompetanseportalen for relevant personell.
- Avvik registreres og behandles i helseforetakets elektroniske avvikssystem. Mottatt oversikt viser at avvik er meldt for området siste to år, og stikkprøver viste at avvik var behandlet og tatt opp som tema i drifts- og personalmøter.
- Mottatt dokumentasjon viser at etterspurt årsrapport var sendt til Helsedirektoratet.
- Internrevisjon ved EAB var gjennomført av helseforetaket i 2019. Mottatt rapport viser at avdelingens håndtering av celler og vev var inkludert i internrevisjonen.
5.6 Hornhinner og øyevev
Helse Bergen har godkjenning fra Helsedirektoratet for «donasjon, uttak, konservering, oppbevaring, koding, merking, bearbeiding og distribusjon av hornhinner beregnet til bruk ved hornhinnetransplantasjoner hos mennesker. Innførsel av øyevev fra San Diego Eye Bank og TissueTech i USA og EuroTissue i Nederland» ved øyeavdelingen.
Øyeavdelingen anskaffer hornhinner, sklera og amnionhinner fra virksomheter innenfor og utenfor EU/EØS. På tidspunktet for tilsynsbesøket kunne ikke øyeavdelingen legge frem gyldig godkjenning som omfattet amnionhinner. Mottatt dokumentasjon viser at skriftlige avtaler med aktuelle leverandører er inngått.
Rutiner for mottak er beskrevet i prosedyrene «Håndtering av sklera og amnion/prokera» og «Prosedyre for utpakking og registrering av hornhinne». Mottakskontrollen for hornhinner, sklera og amnionhinner utføres av lege. Under tilsynsbesøket fikk Helsetilsynet se dokumentasjon som viste at mottakskontroll var utført. Dette inkluderte bl.a. kontroll av temperatur ved mottak og gjennomførte obligatoriske smittetester.
Befaring viste at hornhinner, sklera og amnionhinner blir oppbevart i original emballasje ved temperatur anbefalt fra leverandør. Avdelingen oppga at all håndtering foregår på operasjonsstua, og at tilbakerapportering for brukte graft til ekstern leverandør ble oppgitt å ivaretas av personell ved øyeavdelingen.
Under tilsynet fikk Helsetilsynet i tillegg opplyst følgende:
- Dokumentasjon av sporbarhet mellom donor og mottaker blir ivaretatt ved elektronisk registrering og ved at leverandørens følgedokumenter blir oppbevart i perm.
- Skriftlige rutiner og retningslinjer er utarbeidet og blir vedlikeholdt i helseforetakets elektroniske kvalitetshåndbok.
- Opplæring og vedlikehold av kompetanse blir planlagt og dokumentert i helseforetakets kompetanseportal. Det er utarbeidet egen kompetanseplan for ansatte som jobber med celler og vev.
- Avvik registreres og behandles i helseforetakets elektroniske avvikssystem. Mottatt oversikt viser at avvik er meldt for området siste to år.
- Mottatt dokumentasjon viser at årsrapporter for hornhinner, sklera og amnionhinner for 2020 og 2021 var sendt til Helsedirektoratet.
- Ledelsens gjennomgang utføres årlig, og mottatt dokumentasjon viser at internrevisjon var gjennomført av helseforetaket i 2019.
5.7 Beinvev, Kysthospitalet i Hagevik
Helse Bergen har godkjenning fra Helsedirektoratet for «donasjon, uttak, mottak, konservering, oppbevaring, merking og bearbeiding av beinvev beregnet på allogen transplantasjon til mennesker» ved beinbanken, Kysthospitalet i Hagevik.
Beinbanken tar ut bein fra levende donorer for allogen bruk. Under tilsynsbesøket ble vi informert om at utvelgelse av donorer skjer i forkant av hofteproteseoperasjon etter gitte kriterier beskrevet i prosedyren «KiH beinbank – Donasjon og laboratorieundersøkelser». Obligatoriske smittetester blir tatt ved uttak og seks måneder etter uttak. Signert samtykke fra donor lagres elektronisk i pasientens journal.
Helsetilsynet ble fortalt at høstet bein plasseres i steril, dobbel boks som merkes med dato for høsting og «referansenummer» som beskrevet i prosedyren «KiH beinbank – Arbeidsrutiner ved beindonasjon». Beina blir deretter lagret i fryser for bein i karantene. Dokumentert frigivelse av beinvev gjøres av lege ved kontroll av bl.a. samtykkeskjema og smittetester. Etter frigivelse blir beina flyttet til fryser for frigitt bein. Stikkprøver under tilsynsbesøket viste at merking, oppbevaring og frigivelse av bein var utført som beskrevet i prosedyren.
Under tilsynet fikk Helsetilsynet i tillegg opplyst følgende:
- Dokumentasjon av sporbarhet mellom donor og mottaker blir ivaretatt ved manuell utfylling av skjemaer som lagres i permer. Stikkprøver under tilsynsbesøket bekreftet at sporbarheten var ivaretatt.
- Skriftlige rutiner og retningslinjer er utarbeidet og blir vedlikeholdt i helseforetakets elektroniske kvalitetshåndbok.
- Helsetilsynet har fått opplysninger om at opplæring gjennomføres, men den blir ikke dokumentert i helseforetakets kompetanseportal.
- Avvik registreres og behandles i helseforetakets elektroniske avvikssystem.
- Helsetilsynet fikk informasjon om at avvik blir tatt opp i møter på ulike nivåer for læring og forbedring, men ingen avvik relatert til håndtering av beinvev var meldt siste to år.
- Helse Bergen har etter forrige tilsyn utnevnt en ny ansvarlig person etter forskriften ved beinbanken. Endringen er meldt til Helsedirektoratet.
- Mottatt dokumentasjon viser at etterspurt årsrapport var sendt til Helsedirektoratet.
- Internrevisjon ved ortopedisk klinikk, Haukeland og Kysthospitalet, var gjennomført av helseforetaket i 2019. Mottatt rapport viser at klinikkens håndtering av celler og vev var inkludert i internrevisjonen. Helsetilsynet ble også informert om at beinbanken har en årlig gjennomgang av endringer og status ved beinbanken.
5.8 Bein- og senevev, Beinbanken Haukeland
Helse Bergen har godkjenning fra Helsedirektoratet for «donasjon, uttak, konservering, oppbevaring, merking og bearbeiding av bein- og senevev beregnet på allogen transplantasjon i mennesker» ved ortopedisk avdeling, beinbenken Haukeland.
Beinbanken tar ut bein fra levende donorer og bein- og senevev fra døde donorer. Vi ble under tilsynsbesøket fortalt at døde donorer på forhånd er klarert som organdonor, og at relevante smittetester blir tatt «i forbindelse med klargjøring for å bli donor» som beskrevet i prosedyren «Høsting av bein og sener – avdød donor». Utvelgelse av levende donorer blir utført etter gitte kriterier beskrevet i dokumentet «Donorjournal». Signert samtykke fra levende donorer lagres elektronisk i pasientens journal, og obligatoriske smittetester blir tatt ved uttak og seks måneder etter uttak. Dokumentert frigivelse av beinvev gjøres av lege ved gjennomgang av dokumentet «Donorjournal» som bl.a. inkluderer kontroll av samtykkeskjema og smittetester.
Beinbanken fortalte under tilsynsbesøket at de har to frysere, én for bein i karantene og én for frigitt bein. Høstet beinvev blir oppbevart i dobbel boks merket med «graftnummer» og dato som beskrevet i prosedyren «Høsting av bein fra levende donorer».
Under tilsynet fikk Helsetilsynet i tillegg opplyst følgende:
- Dokumentasjon av sporbarhet mellom donor og mottaker blir ivaretatt ved manuell utfylling av skjemaer som lagres i permer. Stikkprøver under tilsynsbesøket bekreftet at sporbarheten var ivaretatt.
- Skriftlige rutiner og retningslinjer er utarbeidet og blir vedlikeholdt i helseforetakets elektroniske kvalitetshåndbok.
- Opplæring og vedlikehold av sykepleieres kompetanse blir planlagt og dokumentert i helseforetakets kompetanseportal.
- Avvik meldes og håndteres i helseforetakets elektroniske avvikssystem. Mottatt oversikt viser at avvik er meldt for området siste to år.
- Helse Bergen utnevnte i 2020 en ny ansvarlig person etter forskriften ved beinbanken. Endringen er ikke meldt til Helsedirektoratet.
- Helseforetaket har ikke sendt inn årsrapport til Helsedirektoratet siste to år.
- Beinbanken har kvartalsvis gjennomgang av sporbarhetsdokumentasjon og lagerbeholdning i fryser. Gjennomgangen dokumenteres ikke. Internrevisjon ved ortopedisk klinikk, Haukeland og Kysthospitalet, var gjennomført av helseforetaket i 2019. Mottatt rapport viser at klinikkens håndtering av celler og vev var inkludert i internrevisjonen.
5.9 Kraniebein til autolog bruk
Helse Bergen har godkjenning fra Helsedirektoratet for «uttak, konservering, oppbevaring og merking av autologt kraniebein beregnet på reimplantasjon i mennesker» ved nevrokirurgisk avdeling.
Helsetilsynet valgte å gjennomføre dokumenttilsyn for dette området med bakgrunn i tidligere tilsynsfunn og innhentet informasjon og dokumentasjon. I tillegg ble det gjennomført en samtale med ansvarlig person etter forskriften.
Helsetilsynet har mottatt følgende opplysninger:
- Ingen vesentlige endringer er gjennomført etter forrige tilsyn.
- Etter uttak blir autologt kraniebein pakket inn i dobbel boks med plast utenpå.
- Fryseren som benyttes til oppbevaring av autologt kraniebein er låst og kun tilgjengelig for spesielt utpekt personell.
- Bilder mottatt av fryseren viser at den er merket med «Autolog bruk» og at utfylt skjema for rengjøring og vedlikehold henger på utsiden av fryseren.
- Ingen avvik relatert til håndtering av humant kraniebein er meldt siste to år.
- Autologt kraniebein som oppbevares blir gjennomgått årlig i forbindelse med årsrapportering til Helsedirektoratet. Kraniebein som ikke lenger er aktuelle for bruk blir destruert.

Figur 3: Autologt kraniebein som oppbevares i fryser.
Tidligere tilsynsfunn og innhentet informasjon og dokumentasjon ved dette tilsynet ga ikke grunnlag for videre tilsynsmessig oppfølging.
5.10 Smittetesting av donorer av celler og vev
Helse Bergen har godkjenning fra Helsedirektoratet for «testing av donorer av celler og vev». Testing utføres ved mikrobiologisk avdeling
Helsetilsynet valgte å gjennomføre dokumenttilsyn for dette området med bakgrunn i tidligere tilsynsfunn og innhentet informasjon og dokumentasjon.
Helsetilsynet har mottatt følgende opplysninger:
- Ingen vesentlige endringer er gjennomført etter forrige tilsyn.
- Mikrobiologisk avdeling utfører de obligatorisk smittetestene for donorer av celler og vev for alle avdelingene i helseforetaket som har godkjenning etter forskrift om håndtering av humane celler og vev
- Ingen avvik relatert til smittetsting av donorer av celler og vev er meldt siste to år.
- Helseforetaket har gjennomført internrevisjon siste to år og utarbeidet revisjonsplan for de neste to årene som omfatter smittetesting av donorer av celler og vev.
Tidligere tilsynsfunn og innhentet informasjon og dokumentasjon ved dette tilsynet ga ikke grunnlag for videre tilsynsmessig oppfølging.
6. Helsetilsynets vurdering av faktagrunnlaget
6.1 Generelt inntrykk
Helse Bergen har ansvaret for håndtering av humane celler og vev beregnet til bruk på mennesker innenfor flere ulike fagområder. Aktiviteten er organisert under åtte avdelinger underlagt seks ulike klinikker. Årsrapportene fra de godkjente enhetene viser at aktivitetsnivået er svært varierende.
Helse Bergen har fulgt opp krav til ledelse og kvalitetsforbedring gjennom prosedyrer, avvikshåndtering og internrevisjoner. Opplæring blir gjennomført ved alle relevante enheter, men blir i varierende grad dokumentert i helseforetakets kompetanseportal.
Helsetilsynet har spesielt merket seg at avdeling for immunologi og transfusjonsmedisin øver på prosedyrer som sjelden er i bruk for å opprettholde kompetansen på disse områdene.
6.2 Helseforetakets oppfølging ved håndtering av humane celler og vev
Tilsynet avdekket at ledelsen ved Helse Bergen mangler oversikt over helseforetakets håndtering av humane celler og vev ved helseforetaket.
Helsetilsynet mener det er kritikkverdig at bindevevshinner for autolog bruk blir håndtert på øyeavdelingen uten å sikre at kravene i forskrift om håndtering av humane celler og vev blir etterlevd, og uten godkjenning fra Helsedirektoratet. Vi har ikke funnet det hensiktsmessig å gjennomgå alle detaljer i helseforetakets aktiviteter innenfor dette området, men har gjennomført en samtale med involvert personell. Helsetilsynet vil presisere at celler og vev for autolog bruk må sikres spesielt bl.a. fordi det ikke er krav om smittetesting for slikt materiale. Materialet må oppbevares isolert og merkes med «kun til autologt bruk» for å hindre overføring av smitte og feil bruk av materialet.
Helse Bergen har utnevnt en ny ansvarlig person etter forskriften for håndtering av bein- og senevev ved beinbanken på Haukeland. Endringen er ikke meldt til Helsedirektoratet. Helseforetaket har heller ikke sendt inn årsrapport for dette området siste to år.
Helseforetaket gjennomførte flere internrevisjoner i 2019 med håndtering av humane celler og vev som tema, men har ikke avdekket at foretaket håndterer bindevevshinner uten godkjenning fra Helsedirektoratet. Helseforetaket har heller ikke gjennomført internrevisjon siste to år der krav til godkjenning, årsrapportering og melding om vesentlige endringer har vært undersøkt.
6.3 Celler og vev som eksponeres for omgivelsene
Ved håndtering av celler og vev som eksponeres for omgivelsene er det krav om luftkvalitet klasse A, og at dette overvåkes ved jevnlig måling av partikler og CFU (mikroorganismer) som beskrevet i pkt. 2.4.
Avdeling for immunologi og transfusjonsmedisin håndterer hematopoetiske stamceller for autolog og allogen bruk. Luftkvalitet kontrolleres kun ved partikkelmåling. Helsetilsynet vurderer dette som tilstrekkelig da all håndtering foregår i et lukket system som beskrevet i pkt. 5.3, og stamcellene dermed ikke eksponeres for omgivelsene.
Enhet for assistert befruktning eksponerer egg, sæd og embryo for omgivelsene ved håndtering på IVF-laboratoriet. For dette området er det unntak for krav om luftkvalitet klasse A, og kompenserende tiltak bør settes i verk for å redusere antall mikroorganismer og partikler mest mulig, jf. pkt. 2.4. IVF-laboratoriet fremstod som maksimalt utnyttet, noe uryddig og med unødvendige støvsamlende gjenstander. Helsetilsynet vil bemerke at laboratoriet må være lett å holde rent for å unngå kontaminering, og at helseforetaket bør vurdere om kompenserende tiltak skal settes i verk for å sikre at antall partikler og mikroorganismer holdes på et så lavt nivå som mulig.
Sentrale regler:
Sentrale krav i forskrift om håndtering av humane celler og vev som er lagt til grunn for dette tilsynet har vært:
- § 4 Godkjenning og vilkår
- § 5 Årsrapporter og godkjenningsregister
- § 6 Ansvarlig person
- § 7 Krav til personalets kompetanse
- § 8 Internkontroll mv.
- § 9 Avtaler med tredjepart
- § 12 Anlegg og lokaler
- § 13 Oppbevaringsbetingelser
- § 17 Obligatoriske laboratorieundersøkelser for donorer
- § 34 Oppbevaring og frigivelse av produkter
- § 36 Mottak av celler og vev
- § 37 Emballering
- § 38 Merking
- § 40 Sporbarhet
- § 44 Overføring av celler og vev til og fra land utenfor EØS-området
I tillegg har tilsynet omfattet etterlevelse av bioteknologiloven.
7. Helsetilsynets konklusjon
Helsetilsynet har konkludert med ett avvik og én merknad etter tilsyn med håndtering av humane celler og vev ved Helse Bergen HF.
7.1 Avvik
Avvik 1:
Ledelsen ved Helse Bergen HF har mangelfull oversikt over humane celler og vev som benyttes i pasientbehandlingen. Helseforetaket håndterer bindevevshinner uten å sikre at gjeldene regelverk etterleves, og uten godkjenning for denne aktiviteten. Helseforetaket sikrer heller ikke at vesentlige endringer og årsrapporter blir sendt inn for alle områdene. Mangelfull oppfølging fra ledelsen kan ha medført redusert pasientsikkerhet ved donasjon og mottak av humane celler og vev (S).
Avvik fra følgende krav i forskrift om håndtering av humane celler og vev:
§ 4 Godkjenning og vilkår
§ 5 Årsrapporter og godkjenningsregister
§ 6 Ansvarlig person
§ 8 Internkontroll mv.
7.2 Merknad
Merknad:
Egg, sæd og embryo som eksponeres for omgivelsene har unntak fra krav om luftklasse A, men antall mikroorganismer og partikler bør holdes på et så lavt nivå som mulig.
Helse Bergen har spesifisert og overvåker luftkvaliteten på IVF-laboratoriet ved enhet for assistert befruktning. Helsetilsynet anbefaler at helseforetaket også iverksetter kompenserende tiltak for å sikre lavest mulig nivå av mikroorganismer og partikler på laboratoriet.
8. Forventninger til virksomheten og videre oppfølging
Helse Bergen skal følge opp det påpekte avviket.
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 9. juni 2023:
- helseforetakets handlingsplan for korrigerende tiltak
- beskrivelse av hvordan Helse Bergen skal følge opp at iverksatte tiltak fungerer etter hensikten
Med hilsen
Ingerid Herstad Nygaard etter fullmakt
avdelingsdirektør
Elisabeth Try Valø
seniorrådgiver
Brevet er godkjent elektronisk og sendes derfor uten underskrift
Saksbehandler: Elisabeth Try Valø, tlf. 21 52 99 83
Vedlegg: (ikke publisert her)
1 Gjennomføring av tilsynet
2 Dokumentunderlag
3 Program for tilsynsbesøket
4 Deltakerliste
Kopi til:
Helsedirektoratet
Statens legemiddelverk
Statsforvalteren i Vestland
11 autolog bruk: celler og vev som uttas fra og brukes på samme person
2 Eshre: European Society of Human Reproduction and Embryology
3 allogen transplantasjon: celler og vev som uttas fra en person og brukes på en annen