Rapport etter tilsyn med Oslo Universitetssykehus HF - håndtering av egg, sæd og embryo beregnet for assistert befruktning 2025
Oppfølging av tilsynet
Ved dette tilsynet ble det avdekt lovbrudd/avvik. Kontakt etaten som har utført tilsynet for status på lovbruddet/avviket.
Statens helsetilsyn har i perioden 15. november 2024 – 22. mai 2025 gjennomført tilsyn med Oslo universitetssykehus HF. Tilsynet omfattet håndtering av egg, sæd og embryo beregnet for assistert befruktning, og ble utført i henhold til forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev.
Hensikten med tilsynet var å undersøke om ledelsen ved helseforetaket sikrer et høyt beskyttelsesnivå for donorer og mottakere, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på egg, sæd og embryo.
Tilsynet ble gjennomført ved en kombinasjon av informasjonsinnhenting, dokumentgjennomgang og tilsynsbesøk med stikkprøver, befaring og intervju av involvert personell. Tilsynsbesøket fant sted 13.-15. januar 2025.
Helsetilsynet avdekket ett avvik.
Oslo universitetssykehus har ikke fulgt tilstrekkelig opp at donasjonsprøver blir tatt på riktig tidspunkt for
- par som blir utredet utenfor OUS for behandling med assistert befruktning ved OUS og hvor donasjonsprøven er eldre enn tre måneder
- par som blir overført fra behandling ved en ekstern fertilitetsklinikk for videre behandling med assistert befruktning ved OUS
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 15. august 2025
- Helseforetakets handlingsplan for korrigerende tiltak for
- par som blir utredet eksternt før behandling med assistert befruktning ved OUS
- par som blir overført fra behandling ved en ekstern fertilitetsklinikk for videre behandling med assistert befruktning ved OUS
- Beskrivelse av hvordan ledelsen ved OUS vil følge opp at iverksatte tiltak fungerer etter hensikten.
Dokumentasjonen sendes som epost til:postmottak@helsetilsynet.no med kopi til kbk@helsetilsynet.no
Vi gjør oppmerksom på at rapporten er offentlig og vil bli publisert på www.helsetilsynet.no.
1 Tilsynets tema og innhold
Statens helsetilsyn fører jevnlige tilsyn med håndtering av celler og vev. Tilsynet gjennomføres med hjemmel i helsetilsynsloven § 4 og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Hensikten med tilsynet har vært å undersøke om ledelsen ved Oslo universitetssykehus HF, heretter OUS, sikrer et høyt beskyttelsesnivå for donorer og mottakere, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på egg, sæd og embryo.
Vi har undersøkt og vurdert hvordan utvalgte oppgaver blir ivaretatt både faglig og styringsmessig, med særlig vekt på følgende:
- anskaffelse, donasjon, uttak og oppbevaring av egg, sæd og embryo
- endringskontroll i forbindelse med bytte av lokaler, inkludert risikovurdering, validering og kontroll av luftkvalitet
- sporbarhet – mulighet til å identifisere egg, sæd og embryo – fra donor til mottaker og omvendt
- hindring av sykdomsoverføring via egg, sæd og embryo
- oppfølging etter forrige tilsyn
Tilsynet er avgrenset til håndtering av egg, sæd og embryo beregnet for assistert befruktning, fra anskaffelse eller uttak, og til tilbakesetting av embryo.
Selve pasientbehandlingen og øvrig gynekologipraksis ved OUS er ikke omfattet av dette tilsynet.
2 Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer celler og vev til bruk på mennesker etterlever gjeldende lov- og forskriftsbestemmelser.
Sentralt regelverk for tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven/biotl.)
- lov om donasjon og transplantasjon av organ, celler og vev (transplantasjonslova)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
Forskrift om håndtering av humane celler og vev er hjemlet i ulike lover og har egne bestemmelser om internkontroll. Disse bestemmelsene kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
2.2 Nærmere om sporbarhet for egg, sæd og embryo
2.2.1 Innledning
Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev stiller krav til sporbarhet, fra donor til mottaker og omvendt. Hensikten er å bidra til etterlevelse av forskriftens formål om å oppnå et sterkt vern av menneskers helse, herunder unngå at sykdom overføres via celler og vev.
Donors identitet skal ikke gjøres kjent for mottaker eller dennes familie og omvendt, jf. forskriften § 28. Barn som er født etter assistert befruktning med donoregg eller donorsæd, har etter fylte 15 år (tidligere 18 år) rett til å få opplysninger om donors identitet. Barnets rett til opplysninger er regulert i bioteknologiloven § 2-7.
Donorunnfangede barn, eller barn som lurer på om de er donorunnfangede, skal kunne innhente opplysninger om sitt genetiske opphav på bakgrunn av mors identitetsopplysninger. For å legge til rette for denne sporingen har Helsedirektoratet opprettet et sentralt egg- og sæddonorregister (ESDR) i tråd med bioteknologiloven § 2-8. Direktoratet åpnet i februar 2023 i tillegg et sentralt mor-donorkoderegister der fertilitetsklinikkene har plikt til å registrere opplysninger om mor og aktuell donorkode. Ansvaret for ESDR, inkludert opplysninger om mor og donorkode, ble overført til Folkehelseinstituttet 1. januar 2024. Formålet med opplysninger i ESDR er å sikre donorunnfangende barns rett til opplysninger om genetisk opphav jf. bioteknologiloven § 2-7.
Barn født etter bruk av donorsæd på norske klinikker fra og med 2005, eller etter bruk av donoregg fra 1. januar 2021, kan henvende seg til ESDR via helsenorge.no. For å få opplysninger om identiteten til en egg- eller sæddonor, må mors navn og fødselsnummer oppgis.
Registering av sporbarhetsopplysninger om egg- og sæddonorer
Bestemmelsene i forskrift om humane celler og vev og bioteknologiloven om registrering om sporbarhetopplysninger har ulike formål. Registrering av opplysninger skal gjøres i separate registre. Formålet til hvert register er styrende for hvilke opplysninger virksomhetene skal registrere, og hva opplysningene kan brukes til.
Forskriftens krav om registering:
- Donasjonsregister: Hver enkelt virksomhet som håndterer celler og vev har plikt til å føre et donasjonsregister, jf. § 45. Formålet med donasjonsregisteret er å samle inn, og innenfor forskriftens rammer, behandle opplysninger om celler, vev og donorer, herunder bidra til å sikre sporbarhet fra donor til mottaker og omvendt.
Detaljerte minstekrav til hvilke opplysninger virksomhetene må registrere følger av §§ 47-51. Det stilles ulike krav til registrering ut fra virksomhetenes aktivitet, eksempelvis for virksomheter som tilbyr fertilitetsbehandling med assistert befruktning, og virksomheter som har egg- og/eller sædbank.
Virksomheter som både har egg- og/eller sædbank og tilbyr behandling med donoregg eller donorsæd, må ha separate registre for å oppfylle krav i § 48 første ledd og § 48 andre ledd.
Bioteknologilovens krav om registrering:
- Det sentrale egg- og sæddonorregisteret (ESDR): Helse- og omsorgsdepartementet har plikt til å opprette et register for registrering av egg- og sæddonorers identitet. Dette er ivaretatt ved opprettelsen av ESDR, jf. punkt 2.2.1 over. Formålet med registeret er å registrere opplysninger om donors identitet slik at barnets rett til opplysninger kan oppfylles, jf. §§ 2-8, 2-10 og 2-11.
Virksomhetene har plikt til å registrere opplysninger om egg- og sæddonorer i ESDR. Det er ulike krav til hvilke opplysninger som skal registreres i ESDR ut fra virksomhetens aktivitet. Videre skal virksomhetene melde fra til ESDR dersom donor ikke har gitt opphav til barn. Det sentrale registeret kobler donors identitet (navn, fødselsdato og personnummer) til en donorkode. - Egg- og sædbankens lokale donorregister: Hver enkelt egg-/sædbank har plikt til å opprette et lokalt donorregister. Formålet med registeret er å finne en egnet donor jf. bioteknologiloven § 1-10. Opplysningene i det lokale donorregisteret skal også bidra til at sæd fra donor ikke utleveres til assistert befruktning til flere familier hvis donor har gitt opphav til barn i seks familier.
Registeret skal inneholde opplysninger om donorkode, donors fysiske karakteristika og antall familier hvor donor er brukt. Andre relevante opplysninger som skal sikre at donor er egnet for bruk i det aktuelle tilfellet skal også registreres. Det lokale registeret skal være anonymisert.
- Det sentrale mor-donorkoderegisteret: Registrerte opplysninger i ESDR om mors identitet og benyttet donorkode. Disse opplysningene skal være registrert for alle behandlinger med donoregg/donorsæd som har ført til barn i Norge. Formålet med registeret er å bidra til å oppfylle barns rett til informasjon om donors identitet etter bioteknologiloven § 2-7.
Virksomheter som tilbyr assistert befruktning med donoregg og/eller donorsæd må registrere opplysninger om mors identitet, dato for hver behandling og donorkode. Opplysningene skal registreres i mor-donorkoderegisteret senest når barnet er født. Opplysningene om mor skal slettes når det ikke lenger er relevant og nødvendig å oppbevare dem. Eggbanken/sædbanken skal informeres dersom bruk av aktuell donor ikke har ført til fødsel.
Rundskriv om assistert befruktning med donoregg og donorsæd gir veiledning om kravene i lov og forskrift, og anbefalinger fra Helsedirektoratet. Detaljerte krav til hvilke opplysninger som skal registreres i ESDR og mor-donorkoderegisteret fremgår av rundskrivets kapittel 5 og 6. Ved godkjenning av virksomheter som håndterer egg, sæd og embryo for assistert befruktning, stilles det som vilkår at anbefalingene i rundskrivet etterleves. For fullstendig veiledning viser vi til rundskrivet på Helsedirektoratets nettside.
2.3 Nærmere om obligatoriske laboratorieundersøkelser
2.3.1 Obligatoriske laboratorieundersøkelser for donorer
Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev stiller krav til obligatoriske laboratorieundersøkelser for donorer jf. § 17, og til tidspunktet for når donasjonsprøver skal tas jf. § 19. Slik testing er ikke obligatorisk ved partnerdonasjon av sædceller som er prosessert for direkte intrauterin inseminasjon jf. § 21. Det forutsettes at cellene ikke oppbevares før bruk.
Alle obligatoriske smittetester av donorer skal utføres ved et laboratorium godkjent av Direktoratet for medisinske produkter.
2.3.2 Smittetesting av par som får behandling med assistert befruktning
Forskriftens § 23 utdyper tidspunkter for testing ved sæddonasjon. Hovedregelen er at donasjonsprøver skal tas på tidspunkt for donasjon, og i tredje ledd fremgår følgende:
«Ved behandling av det samme paret med assistert befruktning innenfor samme behandlingsforløp, skal det tas nye prøver hvis det har gått mer enn 24 måneder siden forrige prøvetaking.»
I veilederen til forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev utdypes de norske vilkårene for unntaksbestemmelsen i § 23:
Ved partnerdonasjon av kjønnsceller er fornyet testing etter tidspunkt for første uttak (donasjon) ikke obligatorisk dersom
- donasjonen omfatter flere etterfølgende uttak i ett sammenhengende fertilitetsmedisinsk behandlingsforløp,
- donasjonen skjer i det samme par og i samme behandlingsregi,
- begge i paret er funnet testnegative ved siste test, og testene ikke er eldre enn 24 måneder.
I veilederen fremgår det videre at testing likevel er obligatorisk dersom uttak utsettes i mer enn 3 måneder på grunn av forhold som skyldes paret eller dersom helsepersonellet har mistanke om smitte eller risikoatferd.
2.3.3 Smittetesting ved bytte av klinikk og ved utredning utenfor egen klinikk
Smittetesting i «samme behandlingsregi» og «sammenhengende fertilitetsmedisinsk behandlingsforløp» betyr i praksis at behandlingen foregår under samme overordnede styring og ledelse, med samme prosedyrer og rutiner, egne helsepersonell og ressurser. Ved behandling med assistert befruktning innebærer denne forståelsen at bytte av klinikk derfor må anses som endring av behandlingsregi og innebærer at det må tas nye smittetester. Dette tilsier at par som bytter klinikk etter å ha startet behandling og tatt infeksjonsprøver, ikke møter vilkårene for unntaket som tillater 24 måneder mellom hver smittetesting, som beskrevet i veilederen.
For par som henvises til en fertilitetsklinikk etter utredning og smittetesting hos eksempelvis egen gynekolog, kan disse smittetestene benyttes som donasjonsprøve forutsatt at
- smittetestene er tatt som en del av en gynekologisk utredning og ikke i forbindelse med fertilitetsbehandling ved en annen fertilitetsklinikk.
- smittetestene ikke er eldre enn tre måneder. Dersom prøvesvarene er eldre enn tre måneder må fertilitetsklinikken sørge for at ny donasjonsprøve for smittetesting blir tatt.
- ved tvil må nye prøver alltid tas.
Klinikken som behandler par med assistert befruktning har ansvar for at det foreligger prøvesvar på donasjonsprøven, at prøvesvarene er vurdert, at smittetestene er tatt innenfor angitte tidsrom og for at disse er analysert ved et godkjent laboratorium.
2.4 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Klassifisering av avvik:
- Kritisk avvik (K): Avvik som utgjør en signifikant risiko for skade på donor eller mottaker av blod, celler, vev og/eller organer.
- Stort avvik (S): Ikke kritisk avvik som utgjør en indirekte risiko for sikkerheten til donor og mottaker av blod, celler, vev og og/eller organer ved
- avvik fra gjeldende myndighetskrav for håndtering av blod, celler, vev og/eller organer
- svikt i prosedyrene for frigivelse av blod, celler, vev og/eller organer til bruk på mennesker, eller at ansvarlig person ikke har utført sine legale plikter
- manglende godkjenning fra Direktoratet for medisinske produkter for aktuell aktivitet
En kombinasjon av flere mindre mangler som hver for seg ikke utgjør et stort avvik, men som til sammen utgjør et stort avvik, skal rapporteres som det.
- Andre avvik (A): Avvik som ikke kan klassifiseres som kritisk eller stort, men som innebærer manglende samsvar med kravene til god praksis som følger av forskriftene for håndtering av blod, celler, vev og/eller organer.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
3 Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 15. november 2024 – 22. mai 2025.
Tilsynet ble gjennomført på følgende måte:
- Varsel om tilsyn ble sendt 15. november 2024.
Varselbrevet inkluderte et aktivitetsskjema og et egenkontrollskjema. Oslo universitetssykehus (OUS) ble bedt om å fylle ut og returnere skjemaene til Helsetilsynet sammen med etterspurte dokumenter.
I varselbrevet informerte Helsetilsynet om at det ville bli gjennomført tilsynsbesøk ved Oslo universitetssykehus, reproduksjonsmedisinsk avdeling, heretter RMA.
- Innhentede dokumenter ble gjennomgått og vurdert.
Oversikt over dokumenter Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i vedlegg 1.
- Tilsynsbesøket ble gjennomført 13. - 15. januar 2025. Program for tilsynsbesøket er gitt i vedlegg 2. Tilsynsbesøket omfattet
- åpningsmøte
- intervju med involvert personell og deres ledere
- befaring i IVF-laboratoriet ved RMA
- dokumentgjennomgang
- demonstrasjon av registering av sporbarhetsopplysninger
- sluttmøte med presentasjon av Helsetilsynets funn.
Helseforetaket ga tilbakemelding på foreløpig rapport 11. april 2025. Tilbakemeldingen inkluderte et generelt dokument – «Infeksjonsmedisinsk utredning ved assistert befruktning» som beskriver OUS sin fremgangsmåte ved obligatorisk infeksjonsmedisinsk utredning.
På bakgrunn av dette gjennomførte Helsetilsynet et dialogmøte med RMA 29. april 2025.
3.2 Deltakere
Deltakere fra OUS:
- kontaktperson fra virksomheten: Aina Therese Presthus, avdelingsleder, avdeling for revisjon og tilsyn.
- for oversikt over andre deltakere viser vi til vedlegg 3.
Deltakere fra Helsetilsynet:
- seniorrådgiver Kristine Bjerkaas-Kjeldal (revisjonsleder)
- seniorrådgiver Elisabeth Try Valø (revisor)
4 Om virksomheten
OUS er lokal- og akuttsykehus for deler av Oslos befolkning, regionsykehus for befolkningen i Helse Sør-Øst og har i tillegg en rekke nasjonale funksjoner. Helseforetaket omfatter Ullevål sykehus, Rikshospitalet, Radiumhospitalet og Aker sykehus, og har i tillegg aktivitet flere andre steder i Oslo-området.
OUS utreder og behandler enslige kvinner og par med ufrivillig barnløshet ved reproduksjonsmedisinsk avdeling. Avdelingen holder til i nye lokaler på Ullevål stadion. Helseforetaket har godkjenning for «Donasjon, uttak, konservering, oppbevaring, koding, merking, bearbeiding og distribusjon (innenfor og utenfor EU/EØS) av celler og vev, herunder egg fra rekrutterte donorer, beregnet til bruk ved assistert befruktning hos mennesker» etter forskrift om håndtering av humane celler og vev.
Godkjenning av celler og vev beregnet for assistert befruktning må ses i sammenheng med godkjenning etter bioteknologiloven. OUS har godkjenninger for aktuelle metoder for assistert befruktning og for drift av sæd- og eggbank (ikke partner) etter bioteknologiloven. Ved tidspunkt for tilsynsbesøket hadde helseforetaket ikke startet drift av egen eggbank. Helseforetaket har i tillegg godkjenning for vurdering av par og kvinner for preimplantasjonsdiagnostikk (PGD) og tilbyr PGD.
OUS har nasjonalt ansvar for å gi behandling med assistert befruktning til par med HIV- eller hepatittsmitte.
5 Beskrivelse av faktagrunnlaget
I dette kapittelet beskriver vi faktiske forhold som er undersøkt under tilsynet.
Vi har lagt særlig vekt på endringskontroll ved bytte av lokaler og sporbarhetsdokumentasjon ved assistert befruktning. Videre har vi sett på styring og ledelse av oppgaver som er avgjørende for sikkerheten til pasienter som mottar behandling med egg, sæd og embryo.
5.1 Endringskontroll i forbindelse med bytte av lokaler
Flytting til nye lokaler er en stor endring. For at det skal være trygt å være donor og mottaker gjennom denne endringen, må ledelsen sikre at kravene i forskriften etterleves både før, under og etter flytting. Dette krever en systematisk oppfølging som blant annet innebærer risikovurdering, planer for flytteprosessen, validering av kritisk utstyr og kontroll av luftkvalitet.
Det nye IVF-laboratoriet ved reproduksjonsmedisinsk avdeling ble tatt i bruk i august 2024.
5.1.1 Risikoanalyser og plan for flytteprosessen
I forbindelse med flytting til nye lokaler inngikk OUS en skriftlig avtale med et eksternt firma om å bistå helseforetaket ved planlegging av prosjektet. Firmaet utarbeidet en kravspesifikasjon i samarbeid med OUS som blant annet beskriver forskriftens krav til lokalene. Eiendomsavdelingen ved helseforetaket fulgte opp arbeidet med bygget etter overtakelse i januar 2023.
Videre utarbeidet OUS seks risikoanalyser med ulike tema, som anlegg for sentral driftsovervåking (SD-anlegg), rentrom og flytting av biobank. Ved vurdert høy risiko ble risikoreduserende tiltak lagt inn og grad av risiko vurdert på nytt. Ifølge informasjon mottatt under tilsynsbesøket ble tiltakene fulgt opp og iverksatt. Helseforetakets «risikovurderingsskjema» ble benyttet som beskrevet i prosedyren «Validation master plan».
Før flytting utarbeidet ledelsen ved RMA dokumentet «Planlagt flytting av biobanken fra Rikshospitalet til Ullevål stadion». Planen inneholder en tidslinje for aktivitet, involverte personer og «ting å ta hensyn til» ved flytting av nitrogentankene. Helsetilsynet ble fortalt at planen ble fulgt underveis i prosessen. I tillegg ble det utarbeidet en plan for «innflytting og validering for OUS, RMA IVF lab». Planen inkluderte blant annet montering av utstyr, kvalifisering, rengjøring, risikoanalyse, validering, prosedyrekontroll, opplæring og utarbeiding av rapport etter validering.
5.1.2 Identifisering og validering av kritisk utstyr
RMA gikk til anskaffelse av mye nytt utstyr i forbindelse med flytting til nye lokaler, og noe utstyr ble tatt med fra de gamle lokalene. Helseforetaket har utarbeidet prosedyren «Validation master plan» som «beskriver den overordnede strategien for validering ved Reproduksjonsmedisinsk avdeling». Prosedyren ble benyttet til identifisering og dokumentasjon av kritisk utstyr. Alt kritisk utstyr, både nytt og flyttet, ble validert før det ble tatt i bruk i de nye lokalene. RMA opplyste under tilsynsbesøket at prosedyrens beskrivelse av fremgangsmåte ved validering ble fulgt.
Helsetilsynet ble fortalt at relevante prosedyrer er blitt oppdatert/utarbeidet ved behov.
5.1.3 Luftkvalitet på IVF-laboratoriet
Håndtering av egg, sæd og embryo forutsetter egnede lokaler. Forskrift om håndtering av humane celler og vev stiller særlige krav til luftkvaliteten når egg, sæd og embryo eksponeres for omgivelsene.
Det nye IVF-laboratoriet er bygd etter rentrom-standard med sluse, overtrykk og filtrert luft. Avdelingen har egne påkledningsrutiner som inkluderer bytte av klær og sko samt bruk av hette inne på laboratoriet. Skift foregår i slusa der rent og urent område skilles med en benk. I henhold til «Validation master plan» er krav til luftkvalitet satt til GMP klasse A i «steril/sikkerhetsbenker» og klasse D på rentrom.
Laboratoriet fremstod som rent og ryddig. Luftkvalitet ble målt i lokalene før flytting av utstyr og etter at utstyret ble installert. Nye målinger er også utført etter at lokalene ble tatt i bruk. Disse ble målt under bruk. Resultatene var innenfor grensene for klasse A i steril/sikkerhetsbenker og klasse C på rentrommet.
Alle ansatte som benytter rentrommet, har gjennomgått kurs i rentromsteknikk. Prosedyre for rentromsteknikk og opplæringsplan er utarbeidet. Renholdspersonale har fått egen opplæring i rengjøring av laboratoriet. Avdelingen har også besluttet at «profesjonell rengjøring» skal gjennomføres årlig. Under tilsynsbesøket ble det opplyst at luftkvaliteten på laboratoriet skal kontrolleres ved målinger hver tredje måned i minimum to år. Det er ledelsen ved RMA som har ansvaret for å følge opp at dette blir utført.

Figur 1: Bilde over laboratoriet ved RMA
OUS tilbyr behandling med assistert befruktning til par med HIV- eller hepatittsmitte. Ved befaring på laboratoriet fikk vi se at RMA har egne rom, arbeidsbenker, egginkubator og nitrogentanker for håndtering av celler som potensielt kan overføre sykdom.
5.2 Sporbarhetsdokumentasjon ved assistert befruktning
5.2.1 Virksomhetens egenkontroll av dokumenterte opplysninger
Som en del av tilsynet ba Helsetilsynet OUS om å gjennomføre egenkontroll av utvalgte oppgaver. På vegne av helseforetaket har RMA gjennomgått dokumentasjon og journalopplysninger for donorer og mottakere av egg, sæd og embryo ved behandling med assistert befruktning. Kontrollen omfattet opplysninger om fem embryotransfere for hver av de aktuelle behandlingsformene.
Egenkontrollen viste at RMA hadde dokumentert at følgende var utført eller innhentet:
- barneomsorgsattest
- samtykke fra kvinnen/paret
- negativt resultat for obligatoriske smittetester
- utført identitetskontroll
- registrering av sporbarhetsopplysninger
5.2.2 Sporbarhetsopplysninger for donorer og donasjoner
Det stilles særlige krav til registrering av opplysninger i ulike registre for virksomheter som utfører behandling med assistert befruktning og er egg- sædbank jf. rapportens punkt 2.2. Det er bare donorunnfangede barn som har rett på opplysninger om donors identitet, og det kreves gode rutiner for skjerming av donoropplysninger for å hindre at helsepersonell uten tjenstlig behov får innsyn i disse opplysningene.
OUS tilbyr behandling med assistert befruktning ved hjelp av donorsæd fra egen bank. Helsetilsynet beskriver her RMA sin håndtering av opplysninger om donorer og donasjoner som skal registreres i registre med ulike formål. Beskrivelsen bygger på opplysninger gitt under tilsynsbesøket, demonstrasjon av dataløsninger og fra innhentede dokumenter.
RMA skal ha oversikt og registrere opplysninger om donor, donasjoner og mottaker av egg, sæd og embryo i følgende register:
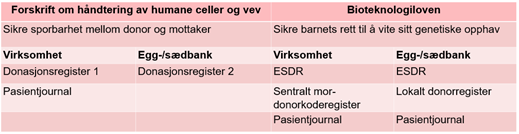
Tabell 1: Oversikt over sporbarhetsregistre
Beskrivelse av bildet:
| Virksomhet | Egg-/sædbank |
|---|---|
| Donasjonsregister 1 | Donasjonsregister 2 |
| Pasientjournal | Pasientjournal |
| Virksomhet | Egg-/sædbank |
|---|---|
| ESDR | ESDR |
| Sentralt mor-donorkoderegister | Lokalt donorregister |
| Pasientjournal | Pasientjournal |
RMA har utarbeidet prosedyren «Donasjon av sæd eller egg ved Reproduksjonsmedisinsk avdeling» som beskriver registrering av sporbarhetsopplysninger etter forskriftens krav om donasjonsregister for både virksomheten som behandler par med assistert befruktning (heretter virksomheten) og sædbanken. Videre beskriver prosedyren sædbankens krav til registrering av sæddonor i det sentrale egg- og sæddonorregisteret og lokalt donorregister, samt virksomhetens krav til registrering i det sentrale mor- donorkoderegisteret. Det gjøres rutinemessig en gjennomgang av utførte behandlinger og fødte barn, og RMA kontakter mødre/par der det mangler opplysninger om barn etter antatt tidspunkt for fødsel. Det er utpekt ulike ansatte som har ansvar for registreringene for sædbank og virksomheten som behandler par med assistert befruktning.
Kun utpekte personer ved OUS har tilgang til å registrere sæddonorer i ESDR. Tilgangsstyring i fagdatasystemet avgrenser hvilke opplysninger personalet har tilgang til.
5.3 Obligatoriske laboratorieundersøkelser
For å beskytte mottaker for smitte via celler og vev stiller forskrift om håndtering av humane celler og vev strenge krav til obligatoriske laboratorieundersøkelser, jf. forskriften §§ 17-23. Resultatene fra smittetestene brukes også for å beskytte ansatte mot smitte.
Ved utredning av pasienter for assistert befruktning ved OUS, blir smittetesting utført som beskrevet i dokumentet «Infeksjonsmedisinsk utredning ved assistert befruktning». Prøver til obligatoriske laboratorieundersøkelser blir tatt under utredning og analysert ved laboratoriet på institutt for medisinsk mikrobiologi, OUS. Testingen gjentas med minimum to års mellomrom.
Under tilsynsbesøket fikk Helsetilsynet informasjon om at OUS har liten kapasitet til fertilitetsutredning av pasienter. Helseforetaket opplyser på sin nettside at det er lang ventetid for fertilitetsbehandling. Raskere behandling er mulig dersom utredning blir utført hos avtalespesialist i gynekologi eller ved andre fertilitetsklinikker, før OUS mottar henvisning om behandling for assistert befruktning. I noen tilfeller ønsker par som er til behandling ved andre klinikker å bytte behandlingssted til OUS. Helseforetaket opplyste under tilsynsbesøket at ved begge disse tilfellene er praksis følgende:
- Undersøker om obligatoriske smittetester er utført før oppstart av behandling ved OUS.
- Smittetester utført for mindre enn to år siden blir godtatt.
- Nye smittetester blir tatt dersom det er to år eller mer siden siste test ble utført.
5.4 Håndtering av egg, sæd og embryo
5.4.1 Identitetskontroll
For å sikre riktig identitet og sporbarhet fra donor til mottaker og omvendt, stiller forskrift om håndtering av humane celler og vev krav til at virksomheten registrerer hvordan og av hvem donor er sikkert identifisert, jf. § 29.
Helsetilsynet fikk opplyst og ble vist hvordan identitetskontroll av pasienter utføres og dokumenteres ved RMA. Legitimasjon blir vist ved første oppmøte i forbindelse med fertilitetsbehandling og deretter ved alle kritiske punkt og ved sæddonasjon. RMA har utarbeidet og følger prosedyren «Identifisering av pasienter og biologisk materiale» som beskriver krav og fremgangsmåte for identifisering av pasienter og egg, sæd og embryo.
5.4.2 Donasjon, uttak og oppbevaring av egg, sæd og embryo
Bioteknologiloven stiller krav til at det er lege som skal velge egnet donor, jf. § 2-10. Forskrift om håndtering av humane celler og vev stiller særlige krav til mottak og merking av celler og vev, samt krav til kritisk utstyr som for eksempel nitrogentanker og inkubatorer.
RMA har gitt følgende opplysninger om donasjon, uttak og oppbevaring:
- Lege velger egnet sæddonor til mottaker ut fra fysiske karakteristika.
- Avdelingen tilbyr kun donorsæd fra egen sædbank.
- Sædbanken har ikke donasjoner samtidig med fertilitetsbehandlingen. Dette for å sikre anonymitet mellom partene.
- Donorsæd som ikke er frigitt for bruk, oppbevares i egen karantenetank.
- Inkubatorer med egg, sæd og embryo har elektronisk loggsystem for kritiske parametere som CO2 og temperatur.
5.4.3 Håndtering av egg, sæd og embryo på laboratoriet
Trygg behandling med assistert befruktning forutsetter at virksomhetene identifiserer og kvalitetssikrer oppgaver der feil kan få alvorlige konsekvenser for pasientene, og for eventuelle barn som blir født etter behandlingen.
RMA benytter «navnelapper som hentes i journal» til merking av skåler og rør med egg, sæd og embryo. Navnelappene inneholder pasientens navn og fødselsnummer. Dobbeltkontroll for å sikre at egg, sæd og embryo tilføres riktige skåler, blir utført og dokumentert i henhold til prosedyren «Kontrollpunkter ved IVF-laboratoriet».
5.5 Ledelse og kvalitetsforbedring
Ledelsen ved helseforetaket skal sørge for at det etableres og gjennomføres systematisk styring av virksomhetens aktiviteter. Her beskriver vi OUS sin kvalitetsstyring på bakgrunn av styrende dokumenter og opplysninger gitt under tilsynsbesøket.
RMA har utarbeidet skriftlige rutiner og instrukser for oppgavene i IVF-laboratoriet. Prosedyrene er tilgjengelige for involvert personell og blir revidert jevnlig.
OUS følger opp egen aktivitet ved blant annet å
- utarbeide prosedyrer og retningslinjer
- planlegge og dokumentere opplæring for ansatte
- registrere og håndtere avvik, samt ta opp feil og hendelser i avdelingsmøter
- gjennomføre internrevisjoner etter fastsatte planer
- utarbeide årsrapporter for aktiviteten
- gjennomføre ledelsens gjennomgang ved egenvurdering og månedlig møte med klinikkleder
6 Helsetilsynets vurderinger
Vi redegjør her for våre vurderinger av faktagrunnlaget opp mot lovgrunnlaget for tilsynet beskrevet i rapportens kapittel 2.
OUS har etablert prosedyrer og retningslinjer for flytting til nye lokaler, registrering av sporbarhetsopplysninger og håndtering av egg, sæd og embryo ved IVF-laboratoriet i henhold til kravene i forskrift om håndtering av humane celler og vev og bioteknologiloven. Helsetilsynet vurderer at OUS har tilstrekkelige systemer for å jevnlig evaluere at disse prosedyrene og retningslinjene blir etterlevd gjennom blant annet avvikshåndtering og internrevisjoner. For områdene endringskontroll i forbindelse med bytte av lokaler, sporbarhetsdokumentasjon og den tekniske håndteringen av egg, sæd og embryo i IVF-laboratoriet, har ikke Helsetilsynet funnet grunnlag for å påpeke avvik.
Ledelsen ved OUS skal også sikre systematisk oppfølging av at donasjonsprøver utføres i henhold til tidspunktene gitt i forskrift om håndtering av humane celler og vev. Ved behandling av par med assistert befruktning gjelder egne bestemmelser og vilkår, se rapportens kapittel 2.3 for nærmere beskrivelse av regelverket. Videre har OUS ansvar for å følge opp at prøvesvarene blir vurdert og at testingen er utført ved et godkjent laboratorium.
For par som blir utredet ved OUS før behandling med assistert befruktning, blir donasjonsprøver til smittetsting tatt i henhold til regelverket.
I de tilfellene OUS får henvist og behandler par med assistert befruktning
etter ekstern fertilitetsutredning, eller ved bytte av klinikk, har helseforetaket valgt å akseptere smittetester fra blodprøver som er tatt for mindre enn 24 måneder siden. For par som henvises etter ekstern utredning, legger Helsetilsynet til grunn at resultater fra smittetester bare kan benyttes som donasjonsprøve dersom prøven ikke er eldre enn tre måneder ved uttak av celler. Ved bytte av klinikk for behandling med assistert befruktning, må ny donasjonsprøve alltid tas dersom celler skal tas ut ved den nye klinikken.
Helseforetaket har systemer for dokumenthåndtering, avviksbehandling, opplæring, internrevisjoner og ledelsens gjennomgang. OUS har gjennomført internrevisjoner ved RMA etter oppsatt plan, men obligatoriske laboratorieundersøkelser for donorer av celler og vev har ikke vært tema siste to år. Helsetilsynet vurderer at ledelsen ved helseforetaket har ikke fulgt tilstrekkelig opp at donasjonsprøven blir tatt på riktig tidspunkt for alle aktuelle pasienter. jf. pkt. 5.3.
7 Helsetilsynets konklusjon
Helsetilsynet har konkludert med ett avvik. Avviket bygger på faktiske opplysninger om tidspunkt for å ta donasjonsprøver for smittetesting av par til behandling med assistert befruktning jf. punkt 5.3 og 5.5. Ledelsen ved helseforetaket har ikke fulgt tilstrekkelig opp at donasjonsprøver i forbindelse med assistert befruktning blir tatt etter forskriftens krav.
Avvik:
Oslo universitetssykehus har ikke fulgt tilstrekkelig opp at donasjonsprøver blir tatt på riktig tidspunkt for
- par som blir utredet utenfor OUS for behandling med assistert befruktning ved OUS og hvor donasjonsprøven er eldre enn tre måneder
- par som blir overført fra behandling ved en ekstern fertilitetsklinikk for videre behandling med assistert befruktning ved OUS
Denne praksisen kan ha ført til at RMA håndterer egg, sæd og embryo i IVF-laboratoriet uten at det foreligger gyldige donasjonsprøver. (S)
Avvik fra følgende krav i forskrift om håndtering av humane celler og vev:
§ 8 Internkontroll mv.
§ 17 Obligatoriske laboratorieundersøkelser for donorer
§ 18 Alminnelige krav som skal være oppfylt ved laboratorieundersøkelser
§ 19 Tidspunkt for uttak av blodprøver eller andre prøver fra levende donor
§ 21 Partnerdonasjon av sædceller
§ 22 Donasjon av sædceller til andre enn partner
§ 23 Tidspunkter for testing ved sæddonasjon
Avvik fra følgende krav i forskrift om ledelse og kvalitetsforbedring i helse- og omsorgssektoren:
§ 6 Plikten til å planlegge
§ 7 Plikten til å gjennomføre
§ 8 Plikten til å korrigere
§ 9 Plikten til å evaluere
8 Forventninger til virksomheten og videre oppfølging
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 15. august 2025
- Helseforetakets handlingsplan for korrigerende tiltak for
- par som blir utredet eksternt før behandling med assistert befruktning ved OUS
- par som blir overført fra behandling ved en ekstern fertilitetsklinikk for videre behandling med assistert befruktning ved OUS
- Beskrivelse av hvordan ledelsen ved OUS vil følge opp at iverksatte tiltak fungerer etter hensikten.
Med hilsen
Ingerid Herstad Nygaard
avdelingsdirektør
Kristine Bjerkaas-Kjeldal
seniorrådgiver
Brevet er godkjent elektronisk og sendes derfor uten underskrift
Saksbehandler: Kristine Bjerkaas-Kjeldal, tlf. 97523746