Rapport etter tilsyn med Universitetssykehuset Nord-Norge HF - håndtering av blod, blodkomponenter, celler og vev 2021
Oppfølging av tilsynet
Ved dette tilsynet ble det avdekt lovbrudd. Tilsynsmyndigheten har vurdert de tiltakene som er satt i verk som tilstrekkelige. Tilsynet er derfor avsluttet.
Statens helsetilsyn har i perioden 6. oktober 2021 – 28. april 2022 gjennomført tilsyn med Universitetssykehuset Nord-Norge HF (UNN). Tilsynet omfattet håndtering av blod, blodkomponenter, celler og vev og ble utført i henhold til følgende forskrifter:
- Forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev
Hensikten med tilsynet var å undersøke om ledelsen ved Universitetssykehuset Nord- Norge HF sikrer et høyt beskyttelsesnivå for givere/donorer og mottakere, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Tilsynsdel 1
På grunn av økt koronasmitte og høy belastning på helseforetaket i forbindelse med pandemien ble det varslede tilsynsbesøket i Tromsø i 2021 erstattet med videomøter for håndtering av blod og blodkomponenter, heretter tilsynsdel 1. Videomøter med involvert personell og deres ledere ble gjennomført i tidsrommet 30. november - 3. desember 2021. I tillegg gjennomgikk Helsetilsynet innhentet informasjon og dokumentasjon. Digitalt sluttmøte for tilsynsdel 1 ble holdt 3. desember 2021.
Tilsynsdel 2
Helseforetakets praksis ved håndtering av humane celler og vev utgjør tilsynsdel 2. I tillegg ble bruk av elektronisk identitetskontroll ved transfusjon fulgt opp. For disse områdene vurderte Helsetilsynet det som nødvending å gjennomføre tilsynsbesøk med befaring i helseforetakets lokaler. Tilsynsbesøket ble gjennomført 9. til 11. februar 2022. I tillegg gjennomgikk Helsetilsynet innhentet informasjon og dokumentasjon. Sluttmøte for tilsynsdel 2 ble holdt 11. februar 2022. Møtet ble gjennomført på UNN/Tromsø med både fysisk og digital deltakelse.
Innenfor områdene som inngår i tilsynsdel 1 avdekket Helsetilsynet ett avvik:
Avvik 1:
Universitetssykehuset Nord-Norge HF samarbeider med kommunehelsetjenesten om transfusjon til pasienter utenfor sykehus. Fordeling av oppgaver og ansvar mellom partene er ikke styrt gjennom avtaler eller gjensidig forpliktende retningslinjer. Mangelfull regulering av samarbeidet med kommunehelsetjenesten kan ha ført til redusert sikkerhet for pasienter ved transfusjon.
Det ble ikke avdekket avvik innen de reviderte områdene for tilsynsdel 2.
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 5. juli 2022.
- helseforetakets handlingsplan for korrigerende tiltak
- beskrivelse av hvordan universitetssykehuset Nord-Norge skal følge opp at iverksatte tiltak fungerer etter hensikten
Dokumentasjon sendes på e-post til med kopi til
Rapporten er offentlig og publisert på www.helsetilsynet.no.
1 Tilsynets tema og innhold
Statens helsetilsyn fører jevnlige tilsyn med håndtering av blod, blodkomponenter, celler og vev. Tilsynet gjennomføres etter helsetilsynsloven § 4, blodforskriften § 5-1 annet ledd og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Hensikten med tilsynet var å undersøke om ledelsen ved Universitetssykehuset Nord- Norge HF (UNN) sikrer et høyt beskyttelsesnivå for mottakere og givere/donorer, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Vi har i dette tilsynet lagt spesielt vekt på følgende:
- Håndtering av blod og blodkomponenter for transfusjon:
- bestilling, pretransfusjonsundersøkelser herunder utstyr/reagenser, valg og utlevering av blod og blodkomponenter
- sporbarhet - mulighet til å identifisere blod og blodkomponenter fra giver til mottaker og omvendt
- samarbeid mellom UNN og kommunehelsetjenesten ved transfusjon
- identitetssikring ved transfusjon, oppfølging etter tidligere tilsyn
- Håndtering av humane celler og vev, inkludert testing av donorer av celler og vev:
- samsvar mellom helseforetakets praksis og godkjenninger etter forskrift om håndtering av humane celler og vev
- håndtering av humane celler og vev ved aktuelle avdelinger
- testing av donorer av humane celler og vev
- oppfølging etter forrige tilsyn (2016)
2 Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer blod, blodkomponenter, celler og vev etterlever gjeldende lov- og forskriftsbestemmelser.
Lovgrunnlag for tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- lov om kommunale helse- og omsorgstjenester m.m. (helse- og omsorgstjenesteloven)
- lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
- forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
Blodforskriften og forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
Transfusjon av blod og blodkomponenter krever samhandling mellom involvert personell ved blodbanker og/eller transfusjonsenheter og kliniske avdelinger. Kravene til sporbarhet og dokumentasjon av gjennomførte transfusjoner i pasientjournal er utdypet i blodforskriften. Oppgaver knyttet til selve transfusjonen er regulert i den generelle helselovgivningen.
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i aktuell forskrift.
2.2 Nærmere om forsvarlighet
Det er et grunnleggende krav til helsetjenesten at den helsehjelpen som ytes er faglig forsvarlig.
Kravet om forsvarlighet er en rettslig standard. Dette innebærer at innholdet bestemmes med utgangspunkt i normer utenfor loven. Disse normene er forankret i anerkjent fagkunnskap, faglige retningslinjer og samfunnsetiske normer, og utgjør det som betegnes som god praksis. Samtidig danner normene utgangspunkt for å fastlegge hvor grensen mot det uforsvarlige går.
Kravet om forsvarlighet er også et krav om forsvarlig organisering av tjenesten. I dette ligger blant annet at det gjennomføres organisatoriske og systemmessige tiltak som gjør det mulig for helsepersonellet å oppfylle plikten til forsvarlig yrkesutøvelse. Det følger av dette at virksomheten må styre sin drift med siktemål om at tjenestene er i samsvar med god praksis.
Det er en nær sammenheng mellom kravet til forsvarlighet, kravet til internkontroll og systematisk arbeid for å ivareta pasientenes sikkerhet, jf. helsetilsynsloven § 5 og forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
2.3 Nærmere om krav om godkjenning
For å trygge donorer og mottakere og sikre åpenhet rundt anskaffelse, donasjon og håndtering av humant materiale beregnet for transfusjon og transplantasjon, stilles det krav om at denne aktiviteten kun skal foregå ved virksomheter med nødvendig godkjenning. I tillegg skal det finnes offentlig tilgjengelig oversikt over godkjente virksomheter og oppgavene de kan utføre.
Blodbanker
Tapping, håndtering og testing av blod og blodkomponenter kan etter blodforskriften bare finne sted ved blodbanker som er godkjent av Helsedirektoratet. En blodbank kan ikke foreta vesentlige endringer i virksomheten uten skriftlig godkjenning fra Helsedirektoratet. Helseforetak har som blodbankens eier ansvaret for at blodbanken har nødvendig godkjenning.
Virksomheter som håndterer celler og vev
Håndtering av humane celler og vev beregnet til anvendelse på mennesker kan bare finne sted ved virksomheter som er godkjent av Helsedirektoratet. Helsedirektoratet kan knytte vilkår til godkjenningene og avgjør blant annet hvilke aktiviteter og framstillingsprosedyrer virksomheter som håndterer humane celler og vev kan utføre.
Helseforetak som eier virksomheter som håndterer celler og vev har ansvaret for at nødvendige godkjenninger etter forskrift om håndtering av humane celler og vev foreligger. Helseforetaket har i tillegg ansvaret for å skaffe seg nødvendige godkjenninger etter bioteknologiloven og registrering som biobank der dette er aktuelt.
2.4 Nærmere om forsvarlighet ved utlevering av blod til transfusjon i kommunehelsetjenesten – norm
Blodmottakere skal være sikret forsvarlige transfusjonstjenester uavhengig av hvor de mottar behandling. Ledelsen ved virksomheter som samarbeider om å utføre transfusjoner, eksempelvis helseforetak og kommuner, skal sørge for implementerte retningslinjer og tydelig ansvars- og oppgavefordeling for alle involverte. Videre skal ledelsen styre alle relevante dokumenter som kan variere over tid med hensyn til versjonsendringer for å hindre utilsiktet bruk av foreldede dokumenter. Prosedyrer og samarbeidsavtaler er eksempler på dokumenter som bør vært styrt, jf. ISO 15189:2012, pkt. 4.3.
Når blod og blodkomponenter transfunderes utenfor spesialisthelsetjenesten skal statlige helseinstitusjoner, eller institusjoner som mottar tilskudd fra regionale helseforetak til sin virksomhet, sørge for at ansatte i spesialisthelsetjenesten settes i stand til å oppfylle plikten til å gi råd, veiledning og opplysninger om helsemessige forhold, jf. spesialisthelsetjenesteloven § 6-3. Hensikten er at den kommunale helse- og omsorgstjenesten settes i stand til å løse sine lovpålagte oppgaver. Vi har lagt til grunn at veiledningsplikten minst bør omfatte retningslinjer for pretransfusjonsundersøkelser, bestilling, mottak, transfusjon av blod og blodkomponenter og melding om uønskede hendelser. I tillegg skal virksomhetene i henhold til blodforskriften og Helsedirektoratets veileder for transfusjonstjenesten sikre sporbarhet, dokumentasjon og tilbakerapportering av utførte transfusjoner.
Forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten pålegger den som har det overordnede ansvaret for et helseforetak å sørge for at virksomhetens aktiviteter planlegges, evalueres og korrigeres i samsvar med lov og forskrift. Denne plikten innebærer en selvstendig aktivitet fra den ansvarlige (øverste leder) ved for eksempel å etterspørre status for prosedyrer, rutiner og avtaler.
Avtaler, retningslinjer, samarbeid og informasjonsutveksling knyttet til utlevering av blod og blodkomponenter beregnet for transfusjon i kommunehelsetjenesten er ment å utgjøre sikkerhetsbarrierer for å hindre feiltransfusjoner med påfølgende pasientskade eller død.
2.5 Generelt om samarbeid ved transfusjon
Ved utlevering av blod og blodkomponenter for transfusjon i kommunehelsetjenesten stilles det strenge krav til blant annet distribusjon, utlevering, oppbevaring og dokumentasjon etter transfusjon, jf. blodforskriften §§ 3-1, 3-2 og 3-12. For å sikre at alle kravene etterleves, er det nødvendig at begge parter oppfyller sin del av forpliktelsene. Helsetilsynet vurderer at dette best kan sikres gjennom en gjensidig forpliktende avtale mellom de to partene der oppgaver og ansvar er regulert.
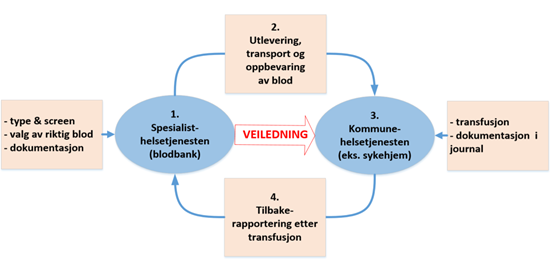
Figur 1: Samarbeid mellom spesialisthelsetjenesten og kommunehelsetjenesten ved transfusjon
Ved utlevering av blod og blodkomponenter til kommunehelsetjenesten har spesialisthelsetjenesten i tillegg en veiledningsplikt som beskrevet i kapittel 2.3.
2.6 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Klassifisering av avvik:
- Kritisk avvik (K): Avvik som utgjør en signifikant risiko for skade på donor eller mottaker av blod, celler, vev og/eller organer.
- Stort avvik (S): Ikke kritisk avvik som utgjør en indirekte risiko for sikkerheten til donor og mottaker av blod, celler, vev og og/eller organer ved
- avvik fra gjeldende myndighetskrav for håndtering av blod, celler, vev og/eller organer
- svikt i prosedyrene for frigivelse av blod, celler, vev og/eller organer til bruk på mennesker, eller at ansvarlig person ikke har utført sine legale plikter
- manglende godkjenning fra Helsedirektoratet for aktuell aktivitet
En kombinasjon av flere mindre mangler som hver for seg ikke utgjør et stort avvik, men som til sammen utgjør et stort avvik, skal rapporteres som det.
- Andre avvik (A): Avvik som ikke kan klassifiseres som kritisk eller stort, men som innebærer manglende samsvar med kravene til god praksis som følger av forskriftene for håndtering av blod, celler, vev og/eller organer.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet.
3 Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 6.oktober 2021 – 7. april 2022.
Tilsynet ble gjennomført på følgende måte:
- Informasjon ble hentet inn i forkant av tilsynet.
Helsetilsynet sendte forespørsel til helseforetaket om antall utleverte enheter blod og blodkomponenter til transfusjon ved eksterne virksomheter. Informasjonen ble mottatt 8. september 2021.
- Varsel om tilsyn ble sendt 6. oktober 2021.
Varselbrevet inkluderte et egenrapportskjema for aktiviteter som omfattes av forskriften samt et egenkontrollskjema for hver av blodbankene. UNN ble bedt om å fylle ut og returnere skjemaene til Helsetilsynet sammen med etterspurte dokumenter.
I varselbrevet informerte Helsetilsynet om at det ville bli gjennomført digitale møter med blodbankene ved helseforetakets sykehus i Harstad og Narvik, samt tilsynsbesøk ved UNN Tromsø.
- Innhentede dokumenter ble gjennomgått og vurdert.
Oversikt over dokumenter Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i vedlegg 1 og 1B.
- Grunnet pandemien og endret smittesituasjon i samfunnet ble det besluttet endringer i gjennomføring av tilsynet. I e-post datert 23. november 2021 mottok helseforetaket informasjon fra Helsetilsynet om at «den endrede smittesituasjonen tilsier endringer i gjennomføring av tilsynet. Vi har derfor besluttet å dele dette tilsynet inn i to – tilsynsdel 1 og tilsynsdel 2»
Tilsynsdel 1 omfatter håndtering av blod og blodkomponenter for transfusjon inkludert transfusjon ved helseforetaket – oppfølging av pågående forbedringsarbeid etter forrige tilsyn.
For tilsynsdel 1 ble tilsynsbesøk ved helseforetaket og de fysiske møtene erstattet av digitale møter. Møter og intervjuer ble gjennomført etter opprinnelig tidsplan.
Videomøtene for tilsynsdel 1 ble gjennomført fra 30. november til 3. desember 2021. Program for videomøtene er gitt i vedlegg 2.
Videomøtene omfattet:
- åpningsmøte
- intervju med involvert personell og deres ledere
- dokumentgjennomgang
- sluttmøte med presentasjon av Helsetilsynets funn
Tilsynsdel 2 ble gjennomført med tilsynsbesøk i Tromsø 9. til 11. februar 2022 og omfattet håndtering av celler og vev, inkludert testing av donorer av celler og vev. I tillegg fortsatte vi oppfølgingen av transfusjon ved helseforetaket –pågående forbedringsarbeid etter tidligere tilsyn. Program for tilsynsbesøket er gitt i vedlegg 2B.
Tilsynsbesøket omfattet:
- åpningsmøte
- intervju av ledere og involvert personell og dokumentgjennomgang samt befaring ved IVF-poliklinikken, ortopedisk avdeling/anestesi- og operasjonsavdeling/beinbank, og laboratoriemedisinsk avdeling i Tromsø.
- intervju av ledere og involvert personell og dokumentgjennomgang ved nevrokirurgisk, øre-nese-hals-øyeavdeling samt gjennomgang av praksis ved transfusjon av blod og blodkomponenter med ledere og involvert personell ved hematologisk avdeling og anestesi- og operasjonsavdeling.
- sluttmøte med presentasjon av Helsetilsynets funn
Aktiviteten knyttet til smittetesting av donorer av celler og vev ble undersøkt ved gjennomgang og vurdering av innsendt dokumentasjon.
3.2 Deltakere tilsynsdel 1
Deltakere fra UNN:
- Kontaktperson fra virksomheten: spesialkonsulent fag- og kvalitetssenteret, Trine Lise Dyngeland.
- For oversikt over andre deltakere viser vi til vedlegg 3.
Deltakere fra Helsetilsynet:
- seniorrådgiver Tone Andersen (revisjonsleder)
- fagsjef Tone Blørstad (revisor)
- seniorrådgiver Kristin Skaane (revisor)
3.3 Deltakere tilsynsdel 2
Deltakere fra UNN:
- Kontaktperson fra virksomheten: spesialkonsulent fag- og kvalitetssenteret, Trine Lise Dyngeland.
- For oversikt over andre deltakere viser vi til vedlegg 3 B
Deltakere fra Helsetilsynet:
- seniorrådgiver Tone Andersen (revisjonsleder)
- fagsjef Tone Blørstad (revisor)
4 Relevante forhold ved virksomheten
Universitetssykehuset Nord-Norge HF dekker en befolkning på over 193 000 innbyggere. De somatiske sykehusene ligger i Tromsø, Harstad, Narvik og Longyearbyen.
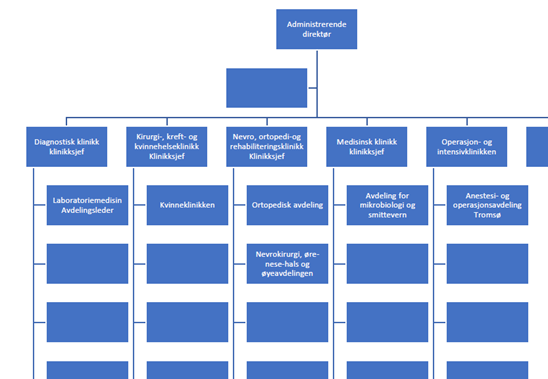
Utdrag av organisasjonskart UNN HF
4.1 Organisering av blodbankvirksomheten UNN
Blodbankvirksomheten ved UNN er organisert under avdeling for laboratoriemedisin, diagnostisk klinikk. Avdeling for Laboratoriemedisin har egen seksjon for blodbankvirksomhet i Tromsø og enheter for blodbankvirksomhet på hvert av sykehusene i Harstad og Narvik. Blodbankvirksomheten heretter kalt blodbanken, har felles prosedyrer innen ledelse og kvalitet. Avdeling for laboratoriemedisin har en egen legegruppe som har medisinsk ansvar for immunologi og transfusjonsmedisin/blodbankene ved UNN.
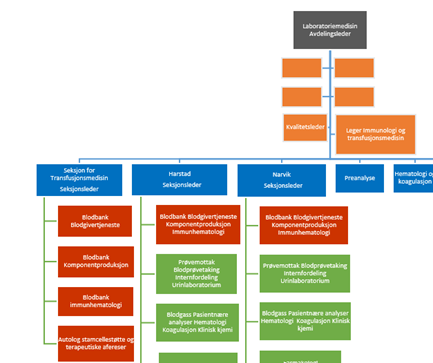
Utdrag av organisasjonskart for avdeling for laboratoriemedisin, UNN. Seksjoner er farget blå, blodbankvirksomheten er farget rød.
Blodbanken UNN Tromsø
Fra 2020 har blodbanken Tromsø vært organisatorisk samlet i seksjon for transfusjonsmedisin. Seksjonen:
- utfører blodtypeserologiske analyser, tapper blodgivere og prosesserer blod, høster stamceller i forbindelse med behandling som krever autolog stamcellestøtte og utfører terapeutisk aferesetapping av erytrocytter, trombocytter og leukocytter, samt plasmautskiftning.
- gir konsulentbistand og opplæring til leger og annet helsepersonell innen fagområdet
- leverer blod og blodkomponenter til sykehusets kliniske avdelinger samt eksterne virksomheter
Blodbankene i Harstad og Narvik
Blodbankene i Harstad og Narvik er organisert som enhetene «Blodbank» under henholdsvis seksjon Harstad og seksjon Narvik, som er direkte underlagt avdeling for laboratoriemedisin. Blodbankene leverer blod til sykehusenes kliniske avdelinger, og blodbanken Narvik leverer av og til blod til eksterne virksomheter. Enhetene tapper blodgivere og prosesserer blod og utfører blodtypeserologiske analyser.
Blod og blodkomponenter transfundert ved UNN i 2020:
|
Sykehus |
SAG (erytrocytter/blod) |
Plasma |
Trombocytter |
|
Tromsø |
6369 |
2229 |
1274 |
|
Harstad |
741 |
42 |
71 |
|
Narvik |
519 |
51 |
28 |
4.2 Organisering av virksomhet knyttet til humane celler og vev ved UNN
UNN har aktivitet knyttet til håndtering av humane celler og vev ved sykehuset i Tromsø.
På tidspunktet for tilsynsbesøket hadde helseforetaket fem godkjente celler og vev virksomheter inkludert smittetesting av donorer av celler og vev. Virksomhetene er organisert under følgende fire klinikker:
- Nevro-, ortopedi- og rehabiliteringsklinikken (NOR)
- Medisinsk klinikk
- Diagnostisk klinikk
- Kirurgi kreft- og kvinnehelseklinikken
Godkjenningene er gitt av Helsedirektoratet etter forskrift om håndtering av humane celler og vev, og omfanget er beskrevet i de følgende punktene for hver enkelt avdeling/enhet. Under tilsynet ble UNN bedt om å undersøke om de, utover den godkjente aktiviteten, også håndterer andre typer celler og vev som faller inn under forskrift om håndtering av humane celler og vev og krever godkjenning fra Helsedirektoratet. Helseforetaket har i sin skriftlige egenrapport til Helsetilsynet opplyst at dette ikke er tilfelle.
I forbindelse med tilsynet valgte UNN å melde fra til Helsedirektoratet om at helseforetaket ikke lenger håndterer brusk og bruskceller, og denne godkjenningen er nå avsluttet.
5 Faktiske forhold, vurdering og konklusjon – tilsynsdel 1
5.1 Oppsummering
Helsetilsynet avdekket ett avvik innen de reviderte områdene for tilsynsdel 1. Avviket gjelder helseforetakets samarbeid med kommunehelsetjenesten om håndtering av blod og blodkomponenter for transfusjon utenfor sykehus. For de øvrige undersøkte områdene ved helseforetakets blodbanker ble det ikke avdekket forhold som ga grunnlag for å påpeke avvik.
5.2 Håndtering av blod og blodkomponenter ved UNN
Vi gir i de følgende punktene en oppsummering av opplysninger og dokumentasjon som er innhentet og gjennomgått i forbindelse med tilsynet. Beskrivelsen av faktiske forhold er i hovedsak avgrenset til tilsynets hovedtema for aktivitet knyttet til blod og blodkomponenter for transfusjon, og gir ikke en fullstendig oversikt over helseforetakets praksis på området.
5.2.1 Helseforetakets egenkontroll
I forkant av tilsynet gjennomførte blodbankene i Tromsø, Harstad og Narvik en egenkontroll i form av stikkprøver ref. pkt. 3.1 ovenfor. Stikkprøvene omfattet kontroll av dokumentasjon for et utvalg utførte oppgaver ved blodbestilling, pretransfusjonsundersøkelser, herunder utstyr/reagenser samt valg og utlevering av blod og blodkomponenter. Helsetilsynet hadde forhåndsdefinert enkelte av de utvalgte oppgavene i forbindelse med blodbestilling og pretransfusjonsundersøkelser som særlig kritiske for pasientsikkerheten, og markert dem i egenkontrollskjemaet. Helseforetakets egenkontroll avdekket ingen avvik.
Under tilsynet ble involvert personell intervjuet om praksis for disse oppgavene.
5.2.2 Identitetssikring ved blodprøvetaking til pretransfusjonsundersøkelse
Helsetilsynet ble fortalt at helseforetaket har én overordnet rutine/retningslinje for identitetskontroll som gjelder ved all blodprøvetaking.
Ved blodbankene i Harstad og Narvik fikk Helsetilsynet opplyst at:
- Ansatte ved blodbanken/laboratoriemedisin tar nesten alle blodprøver til pretransfusjonsundersøkelser.
- Sykepleiere ved kreftenheten tar av og til blodprøver til pretransfusjonsundersøkelser. Involverte sykepleiere har fått opplæring til dette.
- Ved prøvetaking blir pasienten spurt om å oppgi fullt navn og personnummer. Hos pasient som ikke kan gjøre rede for seg blir navnebånd sjekket.
- Prøveglass blir merket med navn, fødselsnummer, dato og klokkeslett.
- Etter blodprøvetaking blir prøvetaker registrert i elektronisk pasientjournal, DIPS. For å sikre at prøvetaker er registrert blir «stikkeliste» i DIPS gjennomgått.
Ved seksjon for transfusjonsmedisin i Tromsø fikk Helsetilsynet opplyst at:
- Involvert personell ved avdeling for laboratoriemedisin og enkelte kliniske avdelinger tar blodprøver til pretransfusjonstesting.
- Prøveglass blir merket med navn, fødselsnummer, dato og klokkeslett.
- Etter blodprøvetaking blir prøvetaker registrert i DIPS.
Tilsynet har ikke intervjuet personell ved kliniske avdelinger som tar prøver til pretansfusjonsundersøkelse.
5.2.3 Kvalitetssikring av de utførte analysene
Helsetilsynet fikk opplyst at analysene som blir utført på blodbanken blir kvalitetssikret ved interne og eksterne kvalitetskontroller. Involvert personell utfører daglig kvalitetskontroll av utvalgte analyser og kvalitetskontroller ved behov. Helsetilsynet fikk demonstrert hvordan resultatene fra de interne kvalitetskontrollene blir fulgt opp.
Blodbankene ved UNN deltar i to eksterne kvalitetsprogram, «nasjonale kvalitetskontroller» og Equalis. Helsetilsynet ble fortalt at overbioingeniør gjennomgår resultatene fra eksterne kvalitetskontroller og har sett dokumentasjon for dette i «Skjema for vurdering av resultat på nasjonale kvalitetskontroller/Equalis». Helsetilsynet fikk opplyst at eventuelle avvik og forslag til tiltak diskuteres på fagmøte, og at eksterne kvalitetsprogramavvik skal registreres i eget avvikssystem. Siste registrerte avvik er fra 2019.
Sentrale regler
- Blodforskriften
- 3-10 jf. vedlegg VI punkt 6.3 Laboratorieundersøkelser.
Kvaliteten til laboratorieundersøkelsene skal vurderes regelmessig ved for eksempel deltakelse i et eksternt kvalitetssikringsprogram.
5.2.4 Kontroll av reagenser og utstyr
Ved blodbankene i Harstad, Narvik og Tromsø fikk Helsetilsynet opplyst at vedlikehold på laboratorieutstyr blir utført i henhold til oppsatte planer. Helsetilsynet ble forevist dokumentasjon på gjennomført vedlikehold.
Helsetilsynet fikk se at mottatte servicerapporter lagres elektronisk på blodbanken.
Blodbankene fortalte at de har rutiner for mottakskontroll av utstyr og reagenser. Helsetilsynet ble vist at nye batcher/nytt lot-nummer av reagenser og celler blir tydelig merket. Blodbanken Tromsø opplyste at de utfører kontroller av ny batch av celler ved mottak.

Reagenser i kjøleskap, Harstad «Celle-lot i bruk»

Reagenser i kjøleskap, Harstad «Neste celle lot»

Etikett for bruk ved ny lot
Temperaturkritiske oppbevaringsområder for reagensene blir overvåket, og Helsetilsynet ble fortalt at alarm går direkte til vaktcalling og til PC-skjerm på blodbanken.
Sentrale regler
- Blodforskriften
- 3-10 jf. vedlegg VI – punkt 4 Utstyr og materialer
Alt utstyr skal valideres, kalibreres og vedlikeholdes så det egner seg til tiltenkt formål.
5.2.5 Samarbeid mellom UNN og kommunehelsetjenesten
UNN samarbeider med kommunehelsetjenesten om transfusjoner til pasienter utenfor sykehus. Tromsø utlever blod jevnlig og Narvik sporadisk.
Helseforetaket har utarbeidet prosedyren «Transfusjonsrutiner i primærhelsetjenesten».
- Prosedyren beskriver gangen fra blodbestilling til avsluttet transfusjon og angir at bestilling skal skje skriftlig på skjemaet «Blodbestilling».
- Prosedyren og skjemaet «Blodbestilling» er tilgjengelig på foretakets nettside.
- Prosedyren «gjelder alle sykepleiere og lege som rekvirerer, mottar blodprodukter og utfører transfusjon av blodprodukter fra UNN».
I prosedyren «Transfusjonsrutiner i primærhelsetjenesten» står det at «Leder i helseinstitusjon har ansvaret for at alle som utfører transfusjoner har oppdatert kunnskap som fyller kravene i blodforskriften. Avdelingsleder på Laboratoriemedisin/Blodbank er ansvarlig for å tilby opplæring i transfusjonsrutiner for de som skal utføre transfusjon av blodprodukter sendt fra UNN».
UNN tilbyr kurs i transfusjonsrutiner og bioingeniør fra blodbanken har på forespørsel besøkt kommunene og holdt klasseromsundervisning. Deltakelse på kurs er blitt dokumentert ved deltakerliste og utstedelse av kursbevis.
Under pandemien har det ikke vært mulig å gjennomføre kurs ved klasseromsundervisning. Helsetilsynet fikk opplyst og har sett at blodbanken ved UNN Tromsø har utarbeidet powerpointpresentasjonen «Transfusjonsrutiner for primærhelsetjenesten 2021» som de har videreformidlet til de kommunene som har etterspurt kurs i transfusjon av blod og blodkomponenter i denne perioden. Helsetilsynet har fått tilgang til et e-læringskurs for transfusjon av blod og blodkomponenter utarbeidet ved UNN Tromsø. En link til dette e-læringskurset ble sendt ut sammen med PowerPoint-presentasjonen, men e-læringskurset er ifølge UNN ikke tilpasset primærhelsetjenesten.
Helsetilsynet fikk beskrevet følgende praksis ved blodbankene i Tromsø og Narvik for utlevering av blod til kommunehelsetjenesten:
- Blodbankene mottar blodbestilling over telefon.
- Blodbanken Narvik ringer til ekstern virksomhet/sykehjem for å forsikre seg om at sykehjemmet har sykepleiere med opplæring i transfusjon. Dette gjøres ikke i Tromsø.
- Blodet blir pakket i kasse med skjema for temperaturlogg og «Skjema for transfusjon i primærhelsetjenesten» samt informasjonsskriv med informasjon hvor kommunehelsetjenesten kan finne prosedyren «Transfusjonsrutiner i primærtjenesten».
- Blodet sendes rutinemessig med taxi/hurtigbåt.
- Blodbankene mottar utfylt temperaturlogg-skjema og «Skjema for transfusjon i primærhelsetjenesten» i retur etter utført transfusjon.
- Alle bestillingene fra primærhelsetjenesten blir registrert i blodbankdatasystemet. I Tromsø blir bestillingene i tillegg skrevet i en rapportbok. Rapportboken gir manuell oversikt over retur av temperaturskjema, «skjema for transfusjon av blodprodukter i primærhelsetjenesten» mm.
Sentrale regler
- Spesialisthelsetjenesteloven
- 6-3 Veiledningsplikt ovenfor den kommunale helse – og omsorgstjenesten
5.2.6 Ledelse og kvalitetsforbedring
Helsetilsynet fikk opplyst at UNN har tatt i bruk kompetansemodul for planlegging og dokumentasjon for gjennomført opplæring og oppdatering. UNN informerte om at opplærings- og oppdateringsplaner ved blodbanken er overført til modulen.
- Kompetanseplaner tildeles hver enkelt ansatt. Hvilke planer hver enkelt ansatt tildeles, tilpasses etter blodbankens behov.
- Opplæring og oppdatering dokumenteres i kompetansemodulen.
- Involvert personell skal årlig gjennomføre en egenevaluering for å kartlegge egen kompetanse og et eventuelt opplæringsbehov.
- Seksjonsleder godkjenner gjennomført opplæring.
Helseforetaket opplyste at elektronisk kvalitetshåndbok automatisk sender varsel til dokumentansvarlig når prosedyrer skal revideres. Hvis dokumentansvarlig ikke overholder fristen for revisjon går det automatisk beskjed til leder.
Blodbankene i Tromsø, Harstad og Narvik har installert nye instrumenter og reagenser til blodtypeserologiske undersøkelser. Helsetilsynet ble fortalt at det ble utført validering av instrumentene og reagensene på alle tre blodbanken og at en felles valideringsrapport foreligger. Helsetilsynet har sett at Blodbanken UNN har retningslinje RL 1337 «Validering» samt skjema SJ12164 «Valideringsplan».
Helsetilsynet ble fortalt at avvik meldes, håndteres og blir tatt opp på avviksmøter én gang pr. måned. UNN informerte om at åpne avvik blir gjennomgått fire ganger i året. Blodbankene tar jevnlig opp avvikene på seksjonsmøter/personalmøter/fagmøter for læring og forbedring. Relevante avvik de siste to år er meldt til Helsedirektoratets meldeordning for «uønskede hendelser ved blodgivning og blodtransfusjon» (Hemovigilans). Helsetilsynet har mottatt oversikt over relevante avviksmeldinger for perioden 01.oktober 2019 – 19.oktober 2021 for blodbankene i Harstad og Narvik og for perioden 01.oktober 2019 – 30.september 2021 for blodbanken i Tromsø.
UNN opplyste at internrevisjonsprogram utarbeides for 5 år og revisjonsplan for 1 år om gangen. Helsetilsynet fått innsyn i nåværende internrevisjonsprogram og revisjonsplan for 2021 og 2022. Internrevisjon er utført de siste to år.
Helsetilsynet fikk opplyst at ledelsens gjennomgang utføres årlig.
Sentrale regler
- Blodforskriften
- 2-3 stiller krav om at oppgaver kun utføres av personale som har fått tilstrekkelig opplæring og er kvalifisert til det, jf. vedlegg VI.
- 2-4 fastsetter at blodbanker og transfusjonsenheter skal etablere internkontroll for å sikre at virksomheten planlegges, organiseres, utføres og vedlikeholdes i samsvar med regler fastsatt i lov og forskrift. Internkontrollen skal tilpasses virksomhetens art, aktiviteter, størrelse og risikoforhold i det omfang som er nødvendig for å etterleve kravene, samt de standarder og spesifikasjoner til et kvalitetsstyringssystem som følger av vedlegg VI. Internkontrollen skal dokumenteres.
5.3 Helsetilsynets vurdering og konklusjon
Transfusjonsmedisin er et sårbart område der feil kan få alvorlige konsekvenser for mottakere av blod og blodkomponenter. Myndighetene stiller derfor strenge krav til virksomheter som håndterer blod og blodkomponenter for transfusjon.
Helsetilsynet har under tilsynsdel 1 undersøkt og vurdert hvordan UNN legger til rette for god pasientsikkerhet ved håndtering av blod og blodkomponenter for transfusjon. Oppgavene som er omfattet av tilsynsdel 1, jf. rapportens kapittel 1, blir i hovedsak utført ved blodbankene ved sykehusene i Tromsø, Narvik og Harstad og ved kliniske avdelinger som transfunderer blod og blodkomponenter. I tillegg har vi undersøkt og vurdert hvordan helseforetaket følger opp samarbeidet med kommunal helse- og omsorgstjeneste ved transfusjon til pasienter utenfor sykehus. De faktiske forholdene ved helseforetaket vi har lagt til grunn for vurdering og konklusjon er nærmere beskrevet over i kapittel 5.
Helsetilsynet har ikke funnet grunnlag for å påpeke avvik for de undersøkte blodbankoppgavene. Dette gjelder foretakets rutiner og retningslinjer for blodbestilling, pretransfusjonsundersøkelser, utstyr og reagenser og for sporbarhet i samsvar med gjeldende krav.
For helseforetakets samarbeid med kommunal helse- og omsorgstjeneste om transfusjon utenfor sykehus, har Helsetilsynet funnet grunnlag for å påpeke ett avvik. UNN har utarbeidet prosedyren «Transfusjonsrutiner i primærhelsetjenesten» som er tilgjengelig på foretakets nettside. Ved utlevering av blodprodukter for transfusjon utenfor sykehus legger blodbanken ved et informasjonsskriv med lenke til denne prosedyren. Det fremgår ikke om helseforetaket har utarbeidet prosedyren i samarbeid med de aktuelle kommunene, eller om den er gjensidig forpliktende.
Etter vår vurdering er det er avgjørende for å sikre trygge transfusjoner også utenfor sykehus, at partene har felles forståelse av hvordan ansvar og oppgaver er fordelt ved eksempelvis bestilling, utlevering, transport, mottak, oppbevaring og sporbarhet for blod og blodkomponenter. Samarbeid om kritiske oppgaver som transfusjon kan etter Helsetilsynets vurdering best sikres gjennom gjensidig forpliktende avtaler.
Helsetilsynet kan heller ikke se at helseforetakets samarbeid med, og veiledning av, kommunal helse- og omsorgstjeneste for transfusjon utenfor sykehus har vært eller er et tema på helseforetakets revisjonsplaner for 2021 og 2022.
Avvik 1:
Universitetssykehuset Nord-Norge HF samarbeider med kommunehelsetjenesten om transfusjon til pasienter utenfor sykehus. Fordeling av oppgaver og ansvar mellom partene er ikke styrt gjennom avtaler eller gjensidig forpliktende retningslinjer. Mangelfull regulering av samarbeidet med kommunehelsetjenesten kan ha ført til redusert sikkerhet for pasienter ved transfusjon.
(S)
Avvik fra følgende krav i spesialisthelsetjenesteloven:
|
§ |
2-2 |
Plikt til forsvarlighet |
|
§ |
6-3 |
Veiledningsplikt ovenfor den kommunale helse- og omsorgssektoren |
5.4 Oppfølging etter forrige tilsyn
Ledelsen ved helseforetaket informerte om at forbedringsarbeidet etter forrige tilsyn med temaet transfusjon av blod og blodkomponenter fortsatt pågår.
Helsetilsynet fikk opplyst at de kliniske avdelingene har tatt i bruk elektronisk kompetansemodul for planlegging, gjennomføring og dokumentasjon av opplæring. Medarbeiderne dokumenterer kjennskap til prosedyrer og gjennomført praksisopplæring i transfusjon i modulen. Kompetansemodulen inneholder også e-læringsprogram for blodtransfusjon. Andel ansatte som har gjennomført den tildelte kompetanseplanen var på undersøkelsestidspunktet 75 %.
Helseforetaket informerte om at de har valgt å innføre elektronisk identitetskontroll ved transfusjon. Elektronisk identitetskontroll blir utført ved hjelp av applikasjonen «Bedside Control Mobile» på mobiltelefon eller Ipod. UNN har startet innføringsarbeidet som en pilot ved en sengepost i Tromsø. Ved denne sengeposten er Bedside ID-kontroll nå tatt i bruk. Fra januar 2022 vil foretaket trinnvis innføre BedSide ID-kontroll ved de øvrige kliniske avdelingene i Tromsø og etterhvert ved sykehusene i Harstad og Narvik.
Elektronisk identitetskontroll i praksis inngår i tilsynsdel 2 og er omtalt under punkt 6.3 i rapporten.
6 Faktiske forhold, vurdering og konklusjon – tilsynsdel 2
6.1 Oppsummering
Helsetilsynet avdekket ikke forhold som ga grunnlag for å påpeke avvik innen de reviderte områdene for tilsynsdel 2 som omfattet håndtering av celler og vev, inkludert testing av donorer av celler og vev.
Vi gir i de følgende punktene en oppsummering av opplysninger og dokumentasjon som er innhentet og gjennomgått i forbindelse med tilsynet. Beskrivelsen av faktiske forhold er i hovedsak begrenset til tilsynets hovedtema for aktivitetene knyttet til celler og vev.
6.2 Håndtering av humane celler og vev ved UNN
6.2.1 Nevro-, ortopedi- og rehabiliteringsklinikken
6.2.1.1 Beinvev
Helseforetaket har godkjenning for «donasjon, uttak, konservering, oppbevaring, koding, merking og bearbeiding av bein og beinvev.» Aktiviteten er lagt til ortopedisk avdeling som har det overordnede ansvar for drift og kontroll av beinbanken.
Anestesti- og operasjonsavdelingen (ANOP) under intensiv- og operasjonsklinikken er ansvarlig for drift av selve beinbanken på vegne av ortopedisk avdeling, jf. prosedyren «OR1.Beinbank: Ledelse, organisering og styring».
Ortopedisk beinvev, kranielapper og amnionhinner oppbevares ved minus 80℃ i beinbankens fryseboks. Fryseren er plassert inne på operasjonsavdelingen. Fryseren er tilkoblet sentralt driftsovervåkingsanlegg (SD) og nødstrøm. Ved alarm varsler vakthavende maskinist ansvarlig personell på operasjonsstua. Helsetilsynet ble fortalt at UNN har en back-up fryser for beinvev.

Beinbankens fryseboks. Ulike typer celler og vev er merket og oppbevares i adskilte områder.
Ortopedisk beinvev
Beinvev blir høstet, pakket i dobbel, steril oppbevaringsboks, merket og lagt i karanteneområdet i beinbankfryseren. Det tas aktuelle serologi- og PCR-smittetester av donorer av beinvev, samt bakteriologiske prøver av høstet beinvev på donasjonstidspunktet. Når svar fra smittetestene og bakteriologisk undersøkelser foreligger, og er besvart som negative, blir beinvevet flyttet fra «karantene bein» til «klarert bein». Tilhørende dokumentasjon blir flyttet fra perm «Karantene bein» til perm «Klarert bein». Beinbanken tilstreber å ha 10 beinvev i fryseren til enhver tid.
Beinbanken har manuelle systemer for registrering av beindonorer og sporbarhetsopplysninger. Dokumentasjonen oppbevares i egne permer for henholdsvis donorjournaler, mottakerjournaler, «karantene bein», «klarert bein» og for «kasserte bein». Permene står i et skap inne på anestesi- og operasjonsavdelingen.

Beinbankens skap med dokumentasjonspermer
Helsetilsynet fikk se:
- dokumentasjon for utførte smittetester for donorer av beinvev
- sporbarhetsopplysninger for donor og mottaker ved transplantasjon av bein
- skriftlige samtykkeerklæringer fra donorer av beinvev
Kranielapper
Hos pasienter med behov for å redusere trykket i hjernen kan operativ fjerning av en bit av kraniet, kranielapp, være aktuell behandling. Kranielappene blir oppbevart for ev. senere tilbakesetting hos samme pasient, autolog bruk. Helsetilsynet ble vist det manuelle kartoteket UNN bruker for dokumentasjon av kranielapper til autolog bruk. Helsetilsynet fikk opplyst at aktuelle serologiske- og PCR-smittetester av pasientene, og bakteriologiske prøver av kranielappene, blir tatt ved uttakstidspunkt. Vi ble fortalt og vist at kranielappene blir pakket sterilt, merket og lagt i eget område i beinbankfryseren. Pasientens strekkode fra elektronisk pasientjournal (DIPS) klistres på kartotekkort og opplysninger om dato for uttak, plass i fryseboks, navn på operasjonssykepleier og kirurg blir dokumentert på kortet.

Manuelt kartotek for registrering av opplysninger om oppbevarte kranielapper for autolog bruk.
Drift av beinbanken følger et eget årshjul. Oppgaver som blant annet temperaturkontroll av fryser, avriming av fryser og scanning av samtykkskjema er lagt inn i årshjulet. I tillegg føres det sjekklister for punktene i årshjulet.

Utklipp av beinbankens årshjul – de første seks månedene og sjekkliste.
Helsetilsynet har sett at:
- Beinbanken har etablert rutiner/prosedyrer for aktuelle oppgaver i beinbanken i elektronisk kvalitetshåndbok (DocMap).
- Beinbanken er i ferd med å ta i bruk kompetanseportalen til dokumentasjon av opplæring og oppfølging.
- Avvik blir meldt og håndtert. Helsetilsynet har mottatt oversikt over meldte avvik/uønskede hendelser for beinbanken de siste 2 år.
- Årsrapport for 2020 er utarbeidet og sendt Helsedirektoratet.
6.2.1.2 Skleralt vev og amnionhinnevev
Helseforetaket har godkjenning for «anskaffelse, mottak og lagring av skleralt vev og amnionhinnevev til bruk ved øyekirurgi.» Håndtering av skleralt vev og amnionhinnevev er lagt til nevrokirurgi-, øre-nese-hals og øyeavdelingen (NKØØ).
Amnionhinner oppbevares i egen boks i beinbankens fryser. Skleralt vev blir oppbevart i romtemperatur ved øyeavdelingen.
Under tilsynsbesøket ble Helsetilsynet vist at:
- Nevrokirurgi, øre- nese- hals og øyeavdeling (NKØØ) har inngått avtale med St. Olavs Hospital HF for kjøp av «sklera-/amniontransplantater.». Signert avtale foreligger.
- Det er etablert retningslinjer og prosedyrer for bestilling, mottakskontroll og oppbevaring av skleralt vev og amnionhinnevev i elektronisk kvalitetshåndbok. Prosedyrene var revidert som forutsatt hvert 2. år.
- Sporbarhetsopplysninger blir dokumentert manuelt.
- NKØØ sender rapporter for brukte og kasserte transplantater tilbake til St. Olavs Hospital.
- Det ikke er meldt avvik knyttet til håndtering av skleralt vev og amnionhinne de siste 2 år.
- Årsrapport for 2020 er utarbeidet og sendt Helsedirektoratet.
6.2.2 Medisinsk klinikk
6.2.2.1 Smittetesting av donorer av celler og vev
UNN har godkjenning for smittetesting av donorer av celler og vev. Aktiviteten er lagt til avdeling for mikrobiologi og smittevern (AMS).
Helsetilsynet besluttet at det ved dette tilsynet var tilstrekkelig å undersøke aktivitet knyttet til smittetesting av donorer av celler og vev ved gjennomgang og vurdering av dokumentasjon. Beslutningen bygger på følgende:
- Helsetilsynet avdekket ikke avvik ved tilsyn med denne aktiviteten i 2017 (tilsynsbesøk).
- Ansvarlig person etter forskrift om håndtering av humane celler og vev er ikke endret siden forrige tilsyn.
- AMS har anskaffet to nye analyseinstrumenter som blir benyttet til donortesting. Det er blitt utført verifisering for aktuelle smittetester. Helsetilsynet har mottatt verifiseringsrapport.
- Avvik blir meldt og håndtert. Helsetilsynet har mottatt oversikt over meldte avvik i perioden 2016-2021.
- Helseforetaket utarbeider revisjonsprogram for AMS. Vi har mottatt program for 2020 og 2021. Program for 2022 vil bli utarbeidet etter ledelsens gjennomgang i løpet av våren.
- AMS har utarbeidet og sendt årsrapport for 2020 til Helsedirektoratet
6.2.3 Diagnostisk klinikk
6.2.3.1 Hematopoetiske stamceller
Helseforetaket har godkjenning for «donasjon, uttak, konservering, oppbevaring, koding, merking og bearbeiding av humane stamceller til autolog bruk». Aktiviteten er lagt til enheten «Autolog stamcelle støtte (HMAS) og terapeutiske afereser» ved transfusjonsmedisinsk seksjon, laboratoriemedisinsk avdeling. Enheten høster stamceller i forbindelse med behandling som krever autolog stamcellestøtte og utfører terapeutiske afereser av erytrocytter, trombocytter og leukocytter, samt plasmautskiftning. Det er kun høsting av autologe stamceller som er omfattet av dette tilsynet.
Helsetilsynet fikk beskrevet følgende praksis for stamcellehøsting i forbindelse med HMAS:
- Lege ved pasientens behandlende avdeling bestiller stamcellehøsting elektronisk via elektronisk pasientjournal (DIPS). Enheten «Autolog stamcelle støtte (HMAS) og terapeutiske afereser» planlegger høsting av stamceller ved afereseteknikk i samarbeid med behandlende avdeling og pasient.
- Stamceller blir høstet i blodbankens lokaler eller på sengepost.
- Cellene blir bearbeidet og merket på laboratoriet. Oppvaringsløsning blir tilsatt stamcellene i LAF-benk.

Stamcellene oppbevares i nitrogentank plassert i egne rom i blodbankens lokaler. Nitrogentankene er koblet opp mot SD-anlegg.
- Enheten har opplæringsplaner og -dokumentasjon i egen mappe i kompetanseportalen og har utarbeidet prosedyrer og retningslinjer i elektronisk kvalitetshåndbok.
- Avvik registreres og håndteres og tas opp i fagmøter for læring. Det skrives referat fra møtene.
Under tilsynsbesøket ble Helsetilsynet vist at:
- Aferesesett og tilsetningsløsninger blir oppbevart i romtemperatur som angitt fra leverandør. Temperaturen blir loggført.
- Sporbarhetsopplysninger registreres i blodbankdatasystemet.
- Vedlikehold blir utført og dokumentert.
- Helseforetaket har inngått avtale med ekstern virksomhet om partikktelling for kontroll av luftkvalitet på laboratoriet. Helsetilsynet har mottatt kopi av avtalen. Enheten utfører selv mikrobiologisk overvåking/CFU-måling.
- Revisjonsprogram Laboratoriemedisin 2020 til 2024 omfatter autolog stamcellestøtte og terapeutiske afereser. Helsetilsynet har mottatt revisjonsprogrammet. Mottatt revisjonsplan for 2022 viser planlagt internrevisjon ved enheten «Autolog stamcelle støtte og terapeutiske afereser» i 2022.
- Årsrapport for 2020 er utarbeidet og sendt Helsedirektoratet.
6.2.4 Kirurgi-, kreft og kvinnehelseklinikken
6.2.4.1 Egg, sæd og embryo for assistert befruktning
Sykehuset i Tromsø etablerte tilbud om assistert befruktning i 1984. Den nåværende IVF-poliklinikken behandler ca. 300 par hvert år for ufrivillig barnløshet. IVF- poliklinikken tilbyr kun fertilitetsbehandling ved bruk av sæd fra partner. I 2020 ble 172 par befruktet.
I tillegg utfører helseforetaket fertilitetsbevarende behandlinger og utredninger.
UNN har godkjenninger etter forskrift om håndtering av humane celler og vev for «Donasjon, uttak, konservering, oppbevaring, koding, merking, bearbeiding og distribusjon av humane celler og vev beregnet til bruk ved assistert befruktning hos mennesker herunder bruk av sædceller fra nedfryste testikkelbiopsier». Aktiviteten er lagt til IVF-poliklinikken i Tromsø.
I tillegg har helseforetaket godkjenning etter bioteknologiloven for behandlingsmetodene som tilbys. Helsetilsynet har fått dokumentert godkjenning for:
- lagring av sæd og lagring av sæd fra menn som skal gjennomgå kreftbehandling mv.
- uthenting av sæd fra testikkel eller bitestikkel til bruk ved assistert befruktning (MESA, TESA, PESA)
- lagring av ubefruktede egg og embryo med og uten medisinsk grunn ved bruk av virtifiseringsmetode
- nedfrysing av ubefruktede egg og ovarievev/eggestokkvev på medisinsk grunnlag for fertilitetsbevarende behandling.
IVF-poliklinikken har tatt i bruk kompetanseportalen for dokumentasjon av opplæring og oppdatering av kompetanse. Poliklinikken har utarbeidet flere opplæringsplaner, en overordet felles plan for alle ansatte på IVF-poliklinikken, en for medisinsk utstyr samt en for hver profesjonsgruppe.
Hver enkelt medarbeider krysser av for utførte oppgaver, veileder godkjenner utførte oppgaver og en evalueringssamtale utføres.
For medisinsk utstyr er det obligatorisk gjennomgang av opplæringsplanen hvert år.
Helsetilsynet har sett at IVF-poliklinikken har etablert rutiner og retningslinjer i elektronisk kvalitetshåndbok for håndtering av egg, sæd og embryo med kobling til kompetanseportalen. Ved endringer i prosedyrer må ansatte dokumentere ved lesekvittering i håndboka.
IVF- poliklinikken har anskaffet og tatt i bruk et kommersielt, elektronisk fagsystem for fertilitetsklinikker for å sikre sporbarhet ved håndtering av egg, sæd og embryo. Systemet ble validert ved anskaffelse, og det er etablert rutiner for verifisering av nye versjoner. Helsetilsynet er forevist signerte og godkjente rapporter.
Ved befaring på poliklinikkens laboratorium fikk Helsetilsynet se at:
- IVF-poliklinikken sørger for at daglig og periodevis vedlikehold for inkubatorer, temperaturregulerte arbeidsbenker og nitrogentank blir utført. Vedlikeholdet er dokumentert. Medisinsk teknisk avdeling (MTA) utfører periodiske kontroller, kalibrering, service og vedlikehold på medisinsk utstyr etter avtale og feilsøking/reparasjoner ved driftsstans.
- Kritiske temperaturer i laboratoriet som kan påvirke egg, sæd og embryo blir kalibrert mot et eksternt termometer. Termometeret er kalibrert.
- Nytt utstyr/nye metoder blir validert/verifisert.
 |
På tidspunktet for tilsynsbesøket fremstod laboratoriearealet som maksimalt utnyttet. Lokalene gir ikke rom for god arbeidsflyt. IVF poliklinikken har iverksatt kompenserende tiltak i laboratoriet ved: - å holde alle overlater ryddige og rene
|
 |
|
 |
6.2.5 Sentrale regler:
Tilsynet med humane celler og vev har omfattet etterlevelse av både bioteknologiloven og forskrift om håndtering av humane celler og vev. Sentrale krav som tilsynet har lagt til grunn for kontrollen har vært
- krav til godkjenning etter bioteknologiloven og forskrift om håndtering av humane celler og vev
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler, vev:
- krav til ledelse, organisering og styring av virksomheten, herunder avtaler med tredjepart
- krav til virksomhetenes lokaler og utstyr mv. ved prosessering
I tillegg har vi sett på forskriftens krav til prosessering, oppbevaring, distribusjon og mottak av celler og vev, krav til sporbarhet, tilbakekall, kvalitet og sikkerhet.
Ettersom tilsynet har omfattet flere aktiviteter og det innen de reviderte områdene ikke er avdekket avvik omtales ikke reglene ytterligere.
6.3 Oppfølging etter forrige tilsyn
Under tilsynsdel 1 i november 2021 fikk Helsetilsynet opplyst at helseforetaket har tatt i bruk applikasjonen «BedsideControl», elektronisk ID-kontroll og transfusjonskvittering på mobiltelefon ved en pilotavdeling ved UNN Tromsø.
Videre fikk Helsetilsynet opplyst at implementering og opplæring i bruk av «BedsideControl» ved de andre kliniske avdelingene skulle starte fra januar 2022.
Under tilsynsdel 2, tilsynsbesøk i februar 2022, ba Helsetilsynet om å få demonstrert bruk av «BedsideControl» ved pilotavdelingen og én annen avdeling.
Ved pilotavdelingen fikk vi demonstrert at sykepleier utførte manuell identitetskontroll av pasient og blodpose og bekreftet denne ved elektronisk dobbeltkontroll. Identitetskontrollen foregikk ved at sykepleieren scannet sin egen identitetskode før hun spurte pasient om navn og personnummer og scannet pasientens navnebånd. Deretter ble blodposen scannet i henhold til gjeldende prosedyre. Etter at alle obligatoriske barkoder var scannet viste et skjermbilde på mobiltelefonen et sammendrag av opplysningene for den aktuelle transfusjonen. Sykepleieren kontrollerte og bekreftet opplysningene ved å trykke «ok» og transfusjonen kunne starte.
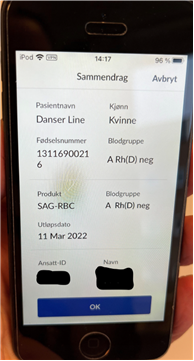 |
Transfusjonskvittering ved bruk av «BedsideControl»: Ved avsluttet transfusjon scanner sykepleier sin identitetskode, pasientens navnebånd og blodposens tappenummer samt registrerer om det har vært transfusjonsreaksjon eller ikke. Et sammendrag kommer opp i displayet og sykepleier bekrefter avsluttet transfusjon ved å trykke «ok». Informasjonen blir registrert i elektronisk pasientjournalsystem og transfusjonskvittering sendes automatisk til blodbankens datasystem. |
Ved den andre avdelingen Helsetilsynet gjennomførte befaring ved ble identitetskontroll fortsatt utført manuelt av to sykepleiere, eventuelt av en lege og en sykepleier, etter gjeldende transfusjonsprosedyre. Helsetilsynet fikk opplyst at den planlagte utrullingen av elektronisk identitetskontroll ved transfusjon ikke var gjennomført som planlagt og opplyst om under tilsynsdel 1 i 2021.
6.4 Helsetilsynets vurdering og konklusjon for tilsynsdel 2
Helsetilsynet har under tilsynsdel 2 undersøkt og vurdert hvordan UNN legger til rette for god pasientsikkerhet ved håndtering av humane celler og vev for bruk på mennesker, inkludert smittetesting av donorer av celler og vev.
Vi har i tillegg undersøkt hvordan helseforetakets ledelse har fulgt opp planlagt og delvis iverksatt forbedringsarbeid etter flere tidligere tilsyn med håndtering av blod og blodkomponenter til transfusjon.
Vi har under punkt 6.4.1 og 6.4.2 vurdert de faktiske forholdene som er avdekket under tilsynsdel 2. Faktiske forhold ved helseforetaket som er lagt til grunn for vurdering og konklusjon er nærmere beskrevet over i kapittel 6.
6.4.1 Vurdering og konklusjon – celler og vev
UNN har aktivitet knyttet til håndtering av beinvev, skleralt vev og amnionhinnevev, hematopoetiske stamceller og egg, sæd og embryo for assistert befrukning samt smittetesting av donorer av celler og vev. Aktiviteten er organisert under fire ulike klinikker, og årsrapportene for håndtering av celler og vev viser at de godkjente enhetene har svært ulikt aktivitetsnivået.
Gjennomgang av innhentede opplysninger og dokumentasjon viste at nødvendige godkjenninger foreligger. Helsetilsynet vurderer at UNN har opprettet systemer for håndtering av celler og vev i tråd med kravene i forskrift om håndtering av humane celler og vev innenfor de reviderte områdene. Tilsynet viste videre at involvert personell bruker tid og ressurser på å planlegge, gjennomføre, evaluere og ev. korrigere aktiviteten for å ivareta pasientsikkerheten for donorer og mottakere av celler og vev.
Helsetilsynet har særlig merket seg at UNN/IVF-poliklinikken har tilpasset behandlingstilbud og aktivitetsnivå til begrensningene ved nåværende areal i IVF- laboratoriet. Håndtering av egg, sæd og embryo beregnet for assistert befruktning forutsetter blant annet egnede lokaler. Ved en eventuelt utvidelse av behandlingstilbud og/eller økt aktivitet vurderer Helsetilsynet at dagens lokaler vil være lite egnede for å opprettholde tilstrekkelig kvalitet og sikkerhet.
Helsetilsynet har ikke funnet grunnlag for avvik innen de reviderte områdene knyttet til håndtering av humane celler og vev inkludert smittetesting av donorer av celler og vev.
6.4.2 Oppfølging etter tidligere tilsyn – identitetskontroll ved transfusjon
Helsetilsynet fikk under tilsynsbesøket ved tilsynets del 2 opplyst at utrullingen av elektronisk ID-kontroll og transfusjonskvittering på mobiltelefon ved UNN ikke hadde startet opp fra 1. januar 2022 som planlagt, jf. punkt 6.3.
Merknad:
UNN HF har gjennom flere år arbeidet for å bedre sikkerheten ved transfusjon. Helseforetaket har blant annet utarbeidet manuelle rutiner for ID-kontroll, e-læringsprogram i transfusjon og tatt i bruk kompetanseportalen. I tillegg har helseforetaket planlagt innføring av elektronisk ID-kontroll og transfusjonskvittering ved transfusjon.
Helsetilsynet anser at elektronisk ID-kontroll og transfusjonskvittering kan bidra til økt pasientsikkerhet ved transfusjon og anbefaler at innføringen blir gjennomført som planlagt.
7 Forventninger til virksomheten og videre oppfølging
Helseforetaket skal følge opp påpekte avvik. Vi gjør oppmerksom på at avviket som er påpekt i dette tilsynet gjelder tilsynsdel 1.
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 5. juli 2022:
- helseforetakets handlingsplan for korrigerende tiltak
- beskrivelse av hvordan ledelsen ved UNN vil følge opp at iverksatte tiltak fungerer etter hensikten
Med hilsen
Ingerid Herstad Nygaard etter fullmakt
avdelingsdirektør
Tone Andersen
seniorrådgiver
Brevet er godkjent elektronisk og sendes derfor uten underskrift
Saksbehandler: Tone Andersen, tlf. 21 52 99 73
Vedlegg:
- Dokumentunderlag UNN – tilsynsdel
1B Dokumentunderlag UNN – tilsynsdel 2 - Program UNN – tilsynsdel 1
2B Program UNN – tilsynsdel 2 - Deltagerliste UNN – tilsynsdel 1
3B Deltagerliste UNN – tilsynsdel 2
Kopi til:
Helsedirektoratet
Statens legemiddelverk
Statsforvalteren i Troms og Finnmark
Spesialkonsulent fag- og kvalitetssenter UNN: Trine Lise Dyngeland