Rapport etter tilsyn Straumann AS – håndtering av produkter som inneholder humane celler og vev
Oppfølging av tilsynet
I dette tilsynet ble det ikke avdekket lovbrudd. Tilsynet er derfor avsluttet.
Statens helsetilsyn har i perioden 16. august – 29. oktober 2019 gjennomført tilsyn ved Straumann AS. Tilsynet omfattet håndtering av produkter som inneholder humane celler og vev, og ble gjennomført etter forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (FOR-2015-12-07-1430).
Formålet med tilsynet var å undersøke om Straumann følger opp og vedlikeholder sine etablerte systemer for å etterleve kravene som følger av forskriftene. Vi har særlig lagt vekt på virksomhetens kvalitetsarbeid, tidligere tilsynsfunn og eventuelle endringer etter forrige tilsyn på det aktuelle området.
Tilsynet ble gjennomført ved gjennomgang og vurdering av innhentet informasjon og dokumentasjon.
Det ble ikke avdekket avvik innen de reviderte områdene. Tilsynet betraktes derfor som avsluttet.
1. Tilsynets tema og innhold
Statens helsetilsyn fører jevnlige tilsyn med håndtering av celler og vev. Tilsynet gjennomføres etter lov om statlig tilsyn med helse- og omsorgstjenesten m.m.
§ 1 og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Formålet med tilsynet var å undersøke om Straumann følger opp og vedlikeholder sine etablerte systemer for å etterleve kravene som følger av forskriftene. Vi har særlig lagt vekt på virksomhetens kvalitetsarbeid, tidligere tilsynsfunn og endringer etter forrige tilsyn for de aktuelle områdene.
2. Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Regelverk som i hovedsak er lagt til grunn under tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev).
Forskrift om håndtering av humane celler og vev stiller krav til ledelsens oppfølging av aktivitet knyttet til håndtering av produkter som inneholder humant beinvev.
2.2 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket ved gjennomgang av tilsendt dokumentasjon og innhentet skriftlig og muntlig informasjon. Tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens lokaler, utstyr og arbeid innenfor de områder tilsynet omfattet.
3. Metode og gjennomføring av tilsynet
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 16. august – 29. oktober 2019. Tilsynet ble gjennomført ved gjennomgang og vurdering av innhentet informasjon og dokumentasjon.
3.1 Metode for tilsynet
Helsetilsynet har tidligere undersøkt håndtering av produkter som inneholder humane celler og vev hos Straumann ved hjelp av tilsynsbesøk og stikkprøver. Etter en vurdering av virksomhetens aktivitet og våre tidligere tilsynsfunn, ble det besluttet som tilstrekkelig å gjennomføre et dokumenttilsyn.
Valg av dokumenttilsyn som metode begrenser omfanget av tilsynet til områder der innhenting av informasjon og dokumentasjon sikrer et godt nok faktagrunnlag.
3.2 Gjennomføring av tilsynet
- Varsel om tilsyn ble sendt 16. august 2019.
Varselbrevet inkluderte et egenrapportskjema for aktiviteter som omfattes av forskriften. Straumann ble bedt om å fylle ut og returnere skjemaet til Helsetilsynet sammen med etterspurte dokumenter.
- Helsetilsynet mottok de etterspurte dokumentene 17. september 2019.
- Gjennomgang og vurdering av dokumenter
Oversikt over dokumentene Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i vedlegg 1.
Etter gjennomgang av etterspurte dokumenter besluttet Helsetilsynet at det ikke var grunn for videre tilsynsmessig oppfølging.
4. Beskrivelse av faktagrunnlaget
I dette kapittelet beskriver vi forhold ved virksomheten som er relevant for tilsynet, og faktiske forhold som ble avdekket under tilsynet.
4.1. Beskrivelse av virksomheten – spesielle forhold
Straumann AS er et heleid norsk datterselskap av sveitsiske Institut Straumann AG. Institut Straumann AG har hovedkontor i Basel, Sveits. Det norske selskapet har hovedkontor i Oslo og ledes av en «National Business Manager».
Aktiviteten til Straumann AS omfatter import, salg og distribusjon av medisinsk utstyr, inkludert dentale implantater. Selskapet har godkjenning fra Helsedirektoratet for oppbevaring og distribusjon av Botiss allograft produkter til tannleger. Disse produktene inneholder humant beinvev, og brukes ved oppbygging av beinstruktur i forbindelse med innsetting av tannimplantat hos pasienter.
4.2. Funn etter forrige tilsyn
Helsetilsynet gjennomførte tilsynsbesøk ved Straumann etter forskrift om håndtering av humane celler og vev i 2016. Tilsynet avdekket ett avvik. Avviket ble håndtert umiddelbart og korrigerende tiltak iverksatt.
4.3 Faktiske forhold som ble avdekket under tilsynet
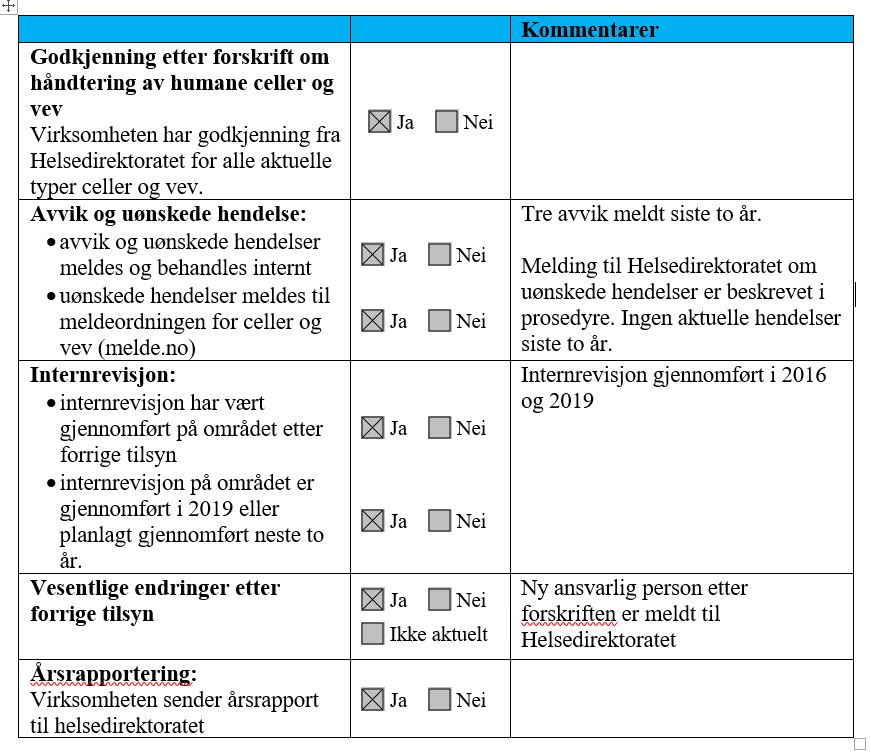
5. Vurdering av faktagrunnlaget opp mot aktuelt lovgrunnlag
Helsetilsynet vurderer at ledelsen ved Straumann følger opp og vedlikeholder etablerte systemer for å etterleve kravene i forskriftene ved å gjennomføre jevnlige internrevisjoner, og ved sin håndtering av endringer, avvik og uønskede hendelser.
6. Tilsynsmyndighetens konklusjon
Det ble ikke avdekket avvik innen de reviderte områdene. Tilsynet betraktes derfor som avsluttet.