Rapport etter tilsyn med håndtering av blod, blodkomponenter, celler og vev Oslo universitetssykehus (OUS) 2021
Oppfølging av tilsynet
Ved dette tilsynet ble det avdekt lovbrudd. Kontakt etaten som har utført tilsynet for status på avviket.
Statens helsetilsyn har i perioden 24. august 2021 – 14. mars 2022 gjennomført tilsyn med Oslo universitetssykehus HF, heretter OUS. Tilsynet omfattet håndtering av blod, blodkomponenter, celler og vev og ble utført i henhold til følgende forskrifter:
- Forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev
Hensikten med tilsynet var å undersøke om ledelsen ved OUS sikrer et høyt beskyttelsesnivå for givere/donorer og mottakere, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Tilsynet ble gjennomført ved innhenting og gjennomgang av informasjon og dokumentasjon. I tillegg ble det gjennomført et digitalt formøte, og tilsynsbesøk med stikkprøver inkludert møter med involvert personell og deres ledere. Tilsynsbesøket fant sted på Ullevål sykehus i perioden 26. -29. oktober 2021, og på Rikshospitalet og i Storgata 40/Legevakten i perioden 1. - 8. november 2021.
Tilsynet avdekket ikke avvik ved helseforetakets håndtering av blod og blodkomponenter. Helsetilsynets generelle inntrykk av aktivitet knyttet til håndtering av humane celler og vev ved OUS er at involvert personell på avdelingsnivå bruker tid og ressurser på å etterleve kravene til kvalitet og sikkerhet.
For å trygge pasientsikkerheten for donorer og mottakere av humane celler og vev stilles det også strenge krav til ledelse og kvalitetsforbedring for denne aktiviteten. Helsetilsynet har avdekket to avvik som viser at ledelsen ved OUS må forbedre følgende områder:
Avvik 1:
Oslo universitetssykehus har etablert en overordnet retningslinje for å veilede aktuelle avdelinger/enheter ved helseforetaket som håndterer humane celler og vev til bruk på mennesker.
Helseforetakets ledelse har ikke i tilstrekkelig grad sikret at alle aktuelle avdelinger/enheter etterlever kravene til kvalitet og sikkerhet ved håndtering av humane celler og vev, har oppdaterte godkjenninger og utpekte ansvarlige personer. Helseforetaket har heller ikke fulgt opp at nye ansvarshavende for behandlingsbiobanker blir utpekt og registrert.
Ledelsens mangelfulle oppfølging kan ha medført manglende oversikt over aktiviteten og redusert pasientsikkerhet ved donasjon og mottak av humane celler og vev.
Avvik 2:
Oslo universitetssykehus sikrer ikke i tilstrekkelig grad at kravene til kvalitet og sikkerhet ved håndtering og lagring av egg, sæd og embryo beregnet for assistert befruktning, kan etterleves for områdene:
- skjerming og sikring av sporbarhetsopplysninger
- lokaler og utstyr
Helsetilsynet anser at ledelsen ved helseforetaket ikke raskt nok og i tilstrekkelig grad har fulgt opp allerede kjent risiko ved håndtering og lagring av egg, sæd og embryo beregnet for assistert befruktning. Helseforetaket har heller ikke sikret egnede systemer for registrering og skjerming av sporbarhetsopplysninger.
Vi ber om at følgende dokumentasjon sendes oss innen 15. juni 2022:
- helseforetakets handlingsplan for korrigerende tiltak
- beskrivelse av hvordan ledelsen ved OUS skal planlegge at iverksatte tiltak fungerer etter hensikten
1 Tilsynets tema og innhold
Statens helsetilsyn fører jevnlige tilsyn med håndtering av blod, blodkomponenter, celler og vev. Tilsynet gjennomføres etter helsetilsynsloven § 4, blodforskriften § 5-1 annet ledd og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Hensikten med tilsynet var å undersøke om ledelsen ved OUS sikrer et høyt beskyttelsesnivå for mottakere og givere/donorer, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Vi har i dette tilsynet lagt spesielt vekt på følgende:
- Håndtering av blod og blodkomponenter for transfusjon:
- oppfølging etter forrige tilsyn
- bestilling, pretransfusjonsundersøkelser herunder utstyr og reagenser, valg og utlevering av blod og blodkomponenter
- sporbarhet - mulighet til å identifisere blod og blodkomponenter fra giver til mottaker og omvendt
- utlevering av blod og blodkomponenter for transfusjon ved eksterne virksomheter
- Håndtering av humane celler og vev, inkludert smittetesting av donorer av celler og vev:
- oppfølging etter forrige tilsyn
- samsvar mellom helseforetakets praksis og godkjenning(er) etter forskrift om håndtering av humane celler og vev, inkludert ledelsens oppfølging av aktiviteten
- håndtering av humane celler og vev ved aktuelle klinikker/avdelinger/enheter
2 Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer blod, blodkomponenter, celler og vev etterlever gjeldende lov- og forskriftsbestemmelser.
Regelverk som i hovedsak er lagt til grunn ved tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- lov om humanmedisinsk bruk av bioteknologi m.m. (bioteknologiloven)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
- forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
Blodforskriften og forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i aktuell forskrift.
2.2 Nærmere om forsvarlighet
Det er et grunnleggende krav til helsetjenesten at den helsehjelpen som ytes er faglig forsvarlig.
Kravet om forsvarlighet er en rettslig standard. Dette innebærer at innholdet bestemmes med utgangspunkt i normer utenfor loven. Disse normene er forankret i anerkjent fagkunnskap, faglige retningslinjer og samfunnsetiske normer, og utgjør det som betegnes som god praksis. Samtidig danner normene utgangspunkt for å fastlegge hvor grensen mot det uforsvarlige går.
Kravet om forsvarlighet er også et krav om forsvarlig organisering av tjenesten. I dette ligger blant annet at det gjennomføres organisatoriske og systemmessige tiltak som gjør det mulig for helsepersonellet å oppfylle plikten til forsvarlig yrkesutøvelse. Det følger av dette at virksomheten må styre sin drift med siktemål om at tjenestene er i samsvar med god praksis.
2.3 Nærmere om krav om godkjenning
For å trygge donorer og mottakere og sikre åpenhet rundt anskaffelse, donasjon og håndtering av humant materiale beregnet for transfusjon og transplantasjon, stilles det krav om at denne aktiviteten kun skal foregå ved virksomheter med nødvendig godkjenning. I tillegg skal det finnes offentlig tilgjengelig oversikt over godkjente virksomheter og oppgavene de kan utføre.
2.3.1 Blodbanker
Tapping, håndtering og testing av blod og blodkomponenter kan etter blodforskriften bare finne sted ved blodbanker som er godkjent av Helsedirektoratet. En blodbank kan ikke foreta vesentlige endringer i virksomheten uten skriftlig godkjenning fra Helsedirektoratet. Helseforetak har som blodbankens eier ansvaret for at blodbanken har nødvendig godkjenning, jf. blodforskriften § 2-2 første ledd.
2.3.2 Virksomheter som håndterer celler og vev
Håndtering av humane celler og vev beregnet til anvendelse på mennesker kan bare finne sted ved virksomheter som er godkjent av Helsedirektoratet. Helsedirektoratet kan knytte vilkår til godkjenningene og avgjør blant annet hvilke aktiviteter og framstillingsprosedyrer virksomheter som håndterer humane celler og vev kan utføre.
Helseforetak som eier virksomheter som håndterer celler og vev har ansvaret for at nødvendige godkjenninger etter forskrift om håndtering av humane celler og vev foreligger. Helseforetaket har i tillegg ansvaret for å skaffe seg nødvendige godkjenninger etter bioteknologiloven og registrering som biobank der dette er aktuelt, jf. forskrift om håndtering av humane celler og vev § 4 sjette ledd.
2.4 Generelt om samarbeid ved transfusjon
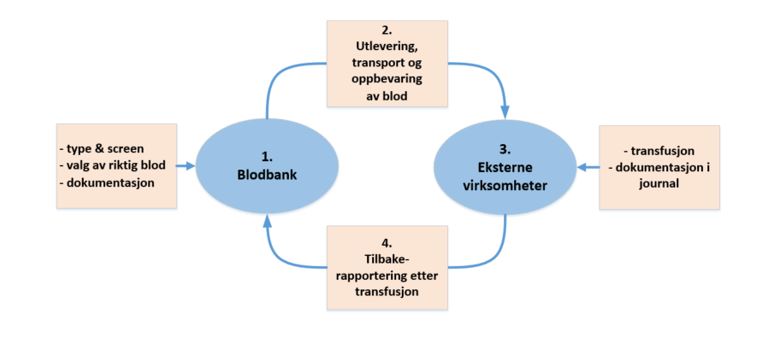
Ved utlevering av blod og blodkomponenter for transfusjon ved eksterne virksomheter stilles det strenge krav til blant annet distribusjon, utlevering, oppbevaring og dokumentasjon etter transfusjon, jf. blodforskriften §§ 3-1, 3-2 og 3-12. For å sikre at alle kravene etterleves, er det nødvendig at begge parter oppfyller sin del av forpliktelsene. Helsetilsynet vurderer at dette best kan sikres gjennom en gjensidig forpliktende avtale mellom de to partene der oppgaver og ansvar er regulert.
2.5 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Klassifisering av avvik:
- Kritisk avvik (K): Avvik som utgjør en signifikant risiko for skade på donor eller mottaker av blod, celler, vev og/eller organer.
- Stort avvik (S): Ikke kritisk avvik som utgjør en indirekte risiko for sikkerheten til donor og mottaker av blod, celler, vev og og/eller organer ved
- avvik fra gjeldende myndighetskrav for håndtering av blod, celler, vev og/eller organer
- svikt i prosedyrene for frigivelse av blod, celler, vev og/eller organer til bruk på mennesker, eller at ansvarlig person ikke har utført sine legale plikter
- manglende godkjenning fra Helsedirektoratet for aktuell aktivitet
En kombinasjon av flere mindre mangler som hver for seg ikke utgjør et stort avvik, men som til sammen utgjør et stort avvik, skal rapporteres som det.
Andre avvik (A): Avvik som ikke kan klassifiseres som kritisk eller stort, men som innebærer manglende samsvar med kravene til god praksis som følger av forskriftene for håndtering av blod, celler, vev og/eller organer.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet.
3 Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 24. august 2021 – 14. mars 2022.
Tilsynet ble gjennomført på følgende måte:
- Informasjon ble hentet inn i forkant av tilsynet.
Helsetilsynet sendte forespørsel til helseforetaket om antall utleverte enheter blod og blodkomponenter til transfusjon ved eksterne virksomheter. Informasjonen ble mottatt 16. juni 2021. - Formøte ble gjennomført 14. september 2021.
Agenda for møtet var praktisk tilrettelegging av tilsynet og hvordan egenrapportskjemaet skulle fylles ut. Fra OUS deltok kontaktperson for tilsynet og hennes stedfortreder. - Varsel om tilsyn ble sendt 24. august 2021.
Varselbrevet inkluderte et egenrapportskjema for aktiviteter som omfattes av blodforskriften og forskrift om håndtering av humane celler og vev, og et egenkontrollskjema for blodbanken. OUS ble bedt om å fylle ut og returnere skjemaene til Helsetilsynet sammen med etterspurte dokumenter.
I varselbrevet ble det informert om at tilsynsbesøk var planlagt gjennomført ved Ullevål sykehus, Rikshospitalet og i Storgata 40/Legevakten i perioden 26. oktober – 8. november 2021. Utkast til program var vedlagt varselbrevet. Det ble gjort oppmerksom på at det kunne bli endringer i programmet etter at Helsetilsynet hadde mottatt etterspurte skjema med vedlegg. - Helseforetakets egenkontroll
Helseforetaket undersøkte og vurderte egen praksis ved blodbanken med utgangspunkt i 10 blodbestillinger. Egenkontrollen omfattet oppgavene bestilling, valg og utlevering av blod og blodkomponenter for transfusjon og pretransfusjonsundersøkelser, herunder utstyr/reagenser.
Innhentede dokumenter ble gjennomgått og vurdert.
Oversikt over dokumenter Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i vedlegg 1. - Tilsynsbesøket ble gjennomført i perioden 26. oktober - 8. november 2021 ved Ullevål sykehus, Rikshospitalet og i Storgata 40/Legevakten. Åpningsmøtet for tilsynet ble gjennomført på Ullevål sykehus 26. oktober. Det ble gjennomført to separate sluttmøter, 29. oktober på Ullevål sykehus for området blod og blodkomponenter og 8. november på Rikshospitalet for celler og vev. Både åpningsmøtet og sluttmøtene kunne følges digitalt.
Det ble gjennomført tilsynsbesøk ved følgende avdelinger/enheter:- avdeling for immunologi og transfusjonsmedisin, Ullevål sykehus – Blodbanken i Oslo
- o reproduksjonsmedisinsk avdeling, laboratorieenheten Rikshospitalet
- ortopedisk klinikk, Storgata 40/Legevakten
- avdeling for transplantasjonsmedisin
- thoraxkirurgisk avdeling
- avdeling for immunologi og transfusjonsmedisin, Ex-vivo cellelaboratoriet
- Det norske benmargsgiverregisteret
I tillegg ble det gjennomført møter for innhenting av informasjon med relevante ledere:
-
- ved nevrokirurgisk avdeling (digitalt) – håndtering av kranielapper for autolog bruk
- ved fødeavdelingen (digitalt) – håndtering av navlestrengsblod og -vev
- ved avdeling for immunologi og transfusjonsmedisin – presentasjon av helseforetakets oppfølging av egen transfusjonspraksis etter tilsynet i 2017
- representanter for helseforetakets ledelse – gjennomgang av helseforetakets oppfølging av avdelinger/enheter som håndterer humane celler og vev til bruk på mennesker
For fullstendig program for tilsynsbesøket viser vi til vedlegg 2
Etter en samlet vurdering av tidligere tilsynsfunn, og innhentet informasjon ved dette tilsynsbesøket, besluttet Helsetilsynet at aktiviteten ved følgende avdelinger kunne undersøkes ved informasjons- og dokumentinnhenting:
-
- øyeavdelingen, senter for øyeforskning (Norsk hornhinnebank), Ullevål sykehus
- avdeling for mikrobiologi, Ullevål sykehus og Rikshospitalet
- avdeling for kreftforskning, seksjon for celleterapi, Radiumhospitalet
- Foreløpig rapport
Helseforetaket ga tilbakemelding på foreløpig tilsynsrapport 28. januar 2022. OUS opplyser her at «Rapporten har vært delt i de involverte klinikker for tilbakemelding på faktafeil. Likeledes ble det presisert at dersom noen hadde pågående arbeide i henhold til lukking av avvik var det åpent for at de kunne sende inn dette i samme tilbakemelding med frist den 1.2.2022. Det er ikke kommet andre tilbakemeldinger enn fra Kvinneklinikken».
Der Helsetilsynet har vurdert det som relevant, er opplysninger fra Kvinneklinikken tatt inn i denne rapporten.
3.2 Deltakere
Deltakere fra OUS:
- kontaktperson fra virksomheten: tilsynskoordinator/rådgiver Anèe Hvass
- for oversikt over andre deltakere viser vi til vedlegg 3.
Deltakere fra Helsetilsynet:
- fagsjef Tone Blørstad (revisjonsleder)
- seniorrådgiver Tone Andersen (revisor)
- seniorrådgiver Kristin Skaane (revisor)
4 Innledende informasjon om helseforetaket
OUS er lokal- og akuttsykehus sykehus for deler av Oslos befolkning, regionsykehus for befolkningen i Helse Sør-Øst og har i tillegg en rekke nasjonale funksjoner. Helseforetaket omfatter Ullevål sykehus, Rikshospitalet, Radiumhospitalet og Aker sykehus, og har i tillegg aktivitet flere andre steder i Oslo-området. OUS er landets største helseforetak med over 24 000 ansatte, og står for en stor del av medisinsk forskning og utdanning av helsepersonell i Norge.
Blod og blodkomponenter
OUS eier landets største blodbank. Nasjonal transfusjonsstatistikk for 2020 oppgir at Blodbanken i Oslo utførte 31075 fullblodtappinger dette året og leverte ut 25761 erytrocyttkonsentrater (røde blodlegemer) for transfusjon i eget helseforetak.
Nasjonal kompetansetjeneste for blodtypeserologi er lagt til OUS, Blodbanken i Oslo, seksjon for immunhematologi. Kompetansetjenesten skal sikre nasjonal kompetansebygging og kunnskapsformidling innen immunhematologi. Seksjon for immunhematologi mottar i tillegg pasientprøver fra hele landet ved behov for videre utredning, og skaffer blod til pasienter med spesielle behov.
Celler og vev
Helseforetaket organiserer totalt 12 godkjente virksomheter for håndtering av humane celler og vev, inkludert smittetesting av donorer av celler og vev. Aktiviteten omfatter kun celler og vev som er beregnet for bruk på mennesker. Nasjonal behandlingstjeneste for fertilitetsbevarende behandling med autologt ovarialvev er lagt til OUS. I tillegg har helseforetaket nasjonalt ansvar for å gi behandling med assistert befruktning til par med HIV- eller hepatittsmitte (egen laboratorieenhet på Ullevål).
OUS håndterer celler og vev innenfor flere fagområder og med stor variasjon i aktivitet og iboende risiko.
Nærmere beskrivelse av faktiske forhold
For nærmere beskrivelse av faktiske forhold knyttet håndtering av blod, blodkomponenter, celler og vev, inkludert smittetesting av donorer av celler og vev, viser vi til
- kapittel 5 - Håndtering av blod og blodkomponenter - faktiske forhold, vurdering og konklusjon
- kapittel 6 - Håndtering av celler og vev - faktiske forhold, vurdering og konklusjon
5 Håndtering av blod og blodkomponenter - faktiske forhold, vurdering og konklusjon
5.1 Oppsummering- blod og blodkomponenter
Helsetilsynet har ikke avdekket avvik innen de undersøkte områdene for håndtering av blod og blodkomponenter til transfusjon.
5.2 Faktiske forhold ved virksomheten
Vi gir i de følgende punktene en oppsummering av opplysninger og dokumentasjon som er innhentet og gjennomgått i forbindelse med tilsynet. Beskrivelsen av faktiske forhold er i hovedsak avgrenset til tilsynets hovedtema for aktivitet knyttet til blod og blodkomponenter for transfusjon, og gir ikke en fullstendig oversikt over helseforetakets praksis på området.
Vi har lagt særlig vekt på følgende områder:
- bestilling, pretransfusjonsundersøkelser herunder utstyr og reagenser, valg og utlevering av blod og blodkomponenter
- sporbarhet - mulighet til å identifisere blod og blodkomponenter fra giver til mottaker og omvendt
- utlevering av blod og blodkomponenter for transfusjon ved eksterne virksomheter
5.2.1 Organisering av blodbankvirksomheten
Blodbanken i Oslo (BiO) er organisert under avdeling for immunologi og transfusjonsmedisin, klinikk for laboratoriemedisin, og hovedaktiviteten er lokalisert på Ullevål sykehus. Avdeling for immunologi og transfusjonsmedisin (IMM) har delt inn blodbankvirksomheten i tre seksjoner, seksjon for blodgiving, seksjon for komponentfremstilling og seksjon for immunhematologi.
BiO forsyner eget helseforetak og flere eksterne virksomheter med blod og blodkomponenter til transfusjon. OUS har oppdatert godkjenning fra Helsedirektoratet for blodbankvirksomheten.
Blod og blodkomponenter blir utlevert til transfusjon i eget helseforetak direkte fra BiO, via transfusjonsenheten ved Radiumhospitalet, utleveringsenheten på Rikshospitalet og fra laboratoriet på Aker sykehus i henhold til lokalt tilpassede rutiner. Eksempelvis kan blod og blodkomponenter bli hentet på transfusjonsenhet/utleveringsenhet av sykepleiere, brakt til enhetene som skal transfundere blod og blodkomponenter av portør eller sendt med rørpost. På Ullevål er det i tillegg et knutepunkt for rørpost der portørtjenesten henter blod og blodkomponenter, pakker i isoporesker og bringer videre til enhetene som skal utføre transfusjonene.
5.2.2 Oppfølging etter forrige tilsyn
Helsetilsynet har ved dette tilsynet innhentet opplysninger om forbedringstiltakene OUS har gjennomført og fulgt opp for identitetssikring ved håndtering av blod og blodkomponenter til transfusjon etter forrige tilsyn (2017).
Blodbanken har oppdatert nivå 1 prosedyren «Transfusjon av blodkomponenter og -produkter» og presisert retningslinjene for identitetssikring og kontroll av blodpose, følgedokumenter og pasient ved transfusjon. I tillegg har blodbanken endret teksten på blodposens følgeseddel slik at den tilsvarer endret prosedyre. For å sikre at sykepleiere og leger som utfører transfusjoner har oppdatert kompetanse foreligger det et opplegg for klasseromsundervisning, og i tillegg er det blitt utarbeidet og oppdatert fem e-læringskurs i transfusjon. E-læringskursene er nå tilgengelige i Læringsportalen. Personell fra blodbanken deltok også med informasjon om identitetskontroll ved transfusjon under pasientsikkerhetsuka i 2018.

Helseforetaket har utarbeidet og oppdatert prosedyrene «Overordnet ansvar for blodtransfusjoner» og «Blodtransfusjoner – opplæring og implementering». Det er blitt etablert et klinisk kompetanseprogram der et av temaene er væsketerapi inkludert transfusjon. Som en del av programmet foreleser spesialist i immunologi og transfusjonsmedisin om temaene «Blodkomponenter og transfusjon, praktiske transfusjonsrutiner, implementering av nivå 1 prosedyrer» og «Transfusjonskomplikasjoner».
OUS har opprettet en midlertidig stilling for «klinisk controller» for å sikre etterlevelse av rutiner og retningslinjer i praksis. Legemiddelhåndtering inkludert dobbeltkontroll er satt som et av fokusområdene i helseforetakets pasientsikkerhetsarbeid.
5.2.3 Bestilling, pretransfusjonsundersøkelser, valg og utlevering av blod og blodkomponenter
Blodbanken i Oslo følger årlig opp et høyt antall transfusjoner med tilhørende pretransfusjonsundersøkelser. Blodbanken leverer transfusjonstjenester internt i eget helseforetak og til eksterne virksomheter både etter faste avtaler og ved akutte behov. Blodbanken har etablert en rekke rutiner, prosedyrer og retningslinjer for å sikre trygge transfusjonstjenester. Helsetilsynet vil bemerke at blodbanken blant annet har:
- innført elektronisk bestilling av blod og blodkomponenter (ved bruk av dataløsningene DIPS, InterInfo og ProSang)
- opprettholdt mulighet til å bestille blod per telefon ved øyeblikkelig hjelp. Disse bestillingene blir på dagtid tatt imot av en egen telefonvakt og dokumentert i en manuell «bestillingsblokk»
- sørget for skriftlige avtaler mellom OUS og eksterne virksomheter som blodbanken regelmessig forsyner med blod og blodkomponenter
- rutiner for mottakskontroll av pretransfusjonsprøver med tilhørende rekvisisjon ved prøvemottak. Prøver som ikke oppfyller definerte krav blir forkastet etter skriftlige retningslinjer. Dette for å sikre at blodtypebestemmelse gjøres i to prøver tatt på ulikt tidspunkt
- rutiner for utlevering av blod og blodkomponenter via rørpost, med portør, bud eller drosje. Alle blodposer er påsatt temperaturknapp

- utarbeidet retningslinjer for medisinsk teknisk utstyr (MTU) i prosedyren «Rutiner knyttet til håndtering av MTU ved IMM». Prosedyren angir oppgaver og ansvar for håndtering av MTU og har lenke til egne prosedyrer for enkeltinstrumenter
- Helsetilsynet ble forevist:
- valideringsplan og -rapport for MTU
- dokumentasjon for utført daglig og periodisk vedlikehold
- servicerapporter fra leverandører
- retningslinjer og dokumentasjon for utførte kvalitetskontroller
- rutiner og dokumentasjon for utført kontroll av reagenser ved mottak, under bruk og eventuelt ved utløpsdato

Helsetilsynet fikk i tillegg opplyst at blodbanken planlegger og styrer fordeling av hvilke blodtypeserologiske tester og utredninger som skal utføres på henholdsvis analyseinstrumenter, ved hjelp av manuelle rutiner eller i en kombinasjon. Valg og vurderinger ble oppgitt å være både faglig begrunnet og et resultat av begrenset kapasitet på analyseinstrumentene.
Sentrale regler
- Blodforskriften § 3-12 krever
- at distribusjon og utlevering av blod og blodkomponenter i alle ledd i transfusjonskjeden skal foregå under slike forhold at produktets integritet og kvalitet bevares.
- at blod og blodkomponenter skal merkes i samsvar med kravene i bestemmelsen og oppbevares i tråd med forskriftens vedlegg III.
Krav til utlevering av blod er utdypet i veileder for transfusjonstjenesten kapittel 12.4
- Blodforskriften § 2-4 krever at blodbanker og transfusjonsenheter skal etablere internkontroll for å sikre at virksomheten planlegges, organiseres, utføres og vedlikeholdes i samsvar med regler fastsatt i lov og forskrift, og at det ved utforming av retningslinjene for god praksis tas hensyn til Europarådets «Guide to the preparation, use and quality assurance of blood components», der det er relevant.
- Blodforskriften vedlegg VI – Standarder og spesifikasjoner til et kvalitetsstyringssystem, jf. § 2-4
- punkt 4 Utstyr og materialer
- punkt 6.3 Laboratorieundersøkelser
- punkt 6.4 Behandling og validering
5.2.4 Sporbarhet for blod og blodkomponenter
Helsetilsynet fikk opplyst at helseforetaket sikrer sporbarhet fra blodgiver til pasient og omvendt ved blant annet:
- elektronisk kobling (forlik) mellom blodmottaker, blodgiver og aktuell blodgiving (tappenummer) i blodbankdatasystemet
- at kliniske enheter/avdelinger fyller ut følgeseddel og transfusjonsjournal for hver transfundert enhet blod og blodkomponent. I tillegg blir utførte transfusjoner dokumentert i elektronisk pasientjournal (EPJ) og eventuelt i elektronisk kurve (MetaVision). Utfylt transfusjonsjournal blir skannet inn i EPJ
- at kliniske avdelinger/enheter, inkludert eksterne virksomheter, gir tilbakemelding om utførte transfusjoner til blodbanken ved å returnere utfylte følgesedler
- at blodbanken gjennomgår og registrerer mottatte følgesedler. Dersom tilbakemelding mangler blir aktuell transfusjon «indirekte rapportert» i blodbankdatasystemet
- at blodbanken følger opp enheter/avdelinger som ikke returnerer følgeskjema, og gjennom flere tilsyn er det dokumentert tilbakemelding for over 90% av utførte transfusjoner. Blodbanken opplyste ved dette tilsynet at det ikke alltid er mulig å få utfylt følgeseddel i retur for alle transfunderte enheter kriseblod
Sentrale regler
Blodforskriften
- § 3-1 stiller krav til at blod og blodkomponenter kan spores fra blodgiver til mottaker og omvendt.
- § 3-2 krever at enhver transfusjon av blod og blodkomponenter skal dokumenteres i pasientens journal i samsvar med forskrift om pasientjournal og at tidspunktet for transfusjonen og identifikasjon av hver enkelt blodenhet eller blodkomponent, registreres.
- § 3-4 stiller krav om at institusjoner straks skal melde fra om mistanke om alvorlige bivirkninger hos mottaker under eller etter transfusjonen som kan tilskrives blodets eller blodkomponentens kvalitet eller sikkerhet til blodbanken, eller om feil blod eller blodkomponent er transfundert.
- § 3-5 krever dokumentasjons- og meldeplikt om alvorlige uønskede hendelser som kan påvirke kvaliteten og sikkerheten ved blod og blodkomponenter
5.2.5 Ledelse og kvalitetsforbedring ved håndtering av blod og blodkomponenter
OUS har etablert overordnede retningslinjer for blant annet interne revisjoner og ledelsens gjennomgang. I praksis følger blodbanken opp transfusjonstjenesten ved blant annet:
- å utarbeide 3-årig revisjonsplan for interne revisjoner. Helsetilsynet har fått forelagt gjeldende plan for perioden 2020 til 2022
- å etablere et transfusjonsutvalg med eget mandat. Kliniske avdelinger er representert i utvalget. I henhold til mandatet skal utvalget utarbeide en årsrapport til helseforetakets direktør. Helsetilsynet har mottatt årsrapport for 2019
- å gjennomføre ledelsens gjennomgang i henhold til helseforetakets overordnede instruks
- planlagt og dokumentert opplæring av personell
- å godkjenne valideringsplaner og -rapporter for nytt og reparert utstyr før utstyret tas i bruk
- skriftlige avtaler med eksterne virksomheter som regelmessig mottar blod og blodkomponenter for transfusjon, inkludert pretransfusjonsundersøkelser, fra BiO. Avtalene regulerer oppgave- og ansvarsfordeling mellom partene. Laboratoriedokumentet «Avtaler, IMM» inneholder oversikt over inngåtte avtaler, gyldighet og ansvar. Jevnlig evaluering av løpende avtaler er ikke beskrevet i dokumentet.
5.2.6 Helsetilsynet har forøvrig merket seg
I forbindelse med tilsynet har Helsetilsynet mottatt opplysninger om pågående utviklings- og forbedringsarbeid ved OUS. Dette arbeidet kan bidra til økt pasientsikkerhet ved transfusjoner. Vi oppfatter arbeidet på disse områdene som særlig positivt:
- blodbankens utviklingsarbeid for å kunne innføre elektronisk identitetskontroll av blodpose, følgedokumenter og pasient. I tillegg vil dette systemet gi mulighet for elektronisk dokumentasjon av hvem som utførte transfusjonen, og tilbakemelding til blodbankdatasystemet etter gjennomført transfusjon
- helseforetakets målsetting om kloke valg ved transfusjoner. Klinikk for laboratoriemedisin har fått ansvaret for et prosjekt i tråd med «Patient Blood Management1» . Hensikten er et systematisk arbeid i helseforetaket for å sikre at alle transfusjoner gis på gode indikasjoner. Helsetilsynet fikk opplyst at mandat for prosjektet vil bli utarbeidet innen utgangen av 2021
1 EDQM - Guide to the preparation, use and quality assurance of blood and blood components, 20th Edition 2020, 11.2.2 Patient blood management.
5.3 Helsetilsynets vurdering og konklusjon for håndtering av blod og blodkomponenter
Helsetilsynet har ved dette tilsynet vurdert hvordan OUS legger til rette for god pasientsikkerhet ved håndtering av blod og blodkomponenter for transfusjon. Oppgavene som er omfattet av dette tilsynet jf. rapportens kapittel 1 blir i hovedsak utført ved Blodbanken i Oslo, seksjon for immunhematologi.
Som beskrevet over i kapittel 5 har Blodbanken i Oslo etablert rutiner og retningslinjer for håndtering av blod og blodkomponenter til transfusjon, inkludert rutiner for opplæring og oppdatering av kompetanse. Etterlevelse av rutiner og retningslinjer blir jevnlig evaluert ved blant annet planlagte internrevisjoner. Helseforetaket har opprettet et transfusjonsråd som rapporterer årlig til direktøren. Helsetilsynet fant også at helseforetaket har fulgt opp tiltakene etter vårt tilsyn i 2017 for å sikre identitetskontroll av pasient, blodpose og følgedokumenter.
Vi har i tillegg merket oss at involvert personell og ledere ved blodbanken under tilsynsbesøket viste høy bevissthet rundt behovet for risikoreduserende tiltak i daglig drift. Faren for feil ved et høyt antall pretransfusjonsundersøkelser og blodtypeserologiske utredninger i forhold til kapasiteten på blodbankens analyseinstrumenter, ble kompensert for ved planlagt og styrt bruk av manuelle rutiner.
Det ble ikke avdekket avvik fra relevant regelverk innen de reviderte områdene.
Sentrale regler
-
Spesialisthelsetjenesteloven § 6-3 fastsetter plikt for helsepersonell til å gi den kommunale helse- og omsorgstjenesten råd, veiledning og opplysninger om helsemessige forhold som er påkrevet for at den kommunale helse- og omsorgstjenesten skal kunne løse sine oppgaver etter lov og forskrift
-
Blodforskriften § 2-4 krever at blodbanker og transfusjonsenheter skal etablere internkontroll for å sikre at virksomheten planlegges, organiseres, utføres og vedlikeholdes i samsvar med regler fastsatt i lov og forskrift
6 Håndtering av celler og vev - faktiske forhold, vurdering og konklusjon
6.1 Oppsummering- celler og vev
Tilsynet viste at involvert personell som håndterer humane celler og vev bruker tid og ressurser på å ivareta sikkerheten for donorer og mottakere.
Helsetilsynet har funnet grunn til å påpeke to avvik knyttet til helseforetakets oppfølging ved håndtering av humane celler og vev, jf. punkt 6.4. Forholdene som er avdekket viser at ledelsen ved OUS ikke i tilstrekkelig grad følger opp og gir veiledning til de enkelte enhetene/avdelingene som håndterer celler og vev.
6.2 Faktiske forhold ved virksomheten
Vi gir i de følgende punktene en oppsummering av opplysninger og dokumentasjon som er innhentet og gjennomgått i forbindelse med tilsynet. Beskrivelsen av faktiske forhold er i hovedsak avgrenset til tilsynets hovedtema for aktivitet knyttet til humane celler og vev, og gir ikke en fullstendig oversikt over helseforetakets praksis på området.
Vi har lagt særlig vekt på følgende:
- oppfølging etter forrige tilsyn
- samsvar mellom helseforetakets praksis og godkjenninger etter forskrift om håndtering av humane celler og vev, inkludert ledelsens oppfølging av aktiviteten
- håndtering av humane celler og vev ved aktuelle klinikker/avdelinger/enheter
6.2.1 Organisering av virksomhet knyttet til håndtering av humane celler og vev
OUS har avdelinger/enheter som håndterer humane celler og vev til bruk på mennesker (transplantasjon) ved Ullevål sykehus, Rikshospitalet, Radiumhospitalet og Storgata 40/Legevakten. I tillegg utfører helseforetaket smittetesting av donorer av celler og vev.
På tidspunktet for tilsynet hadde helseforetaket 12 godkjente celler og vev virksomheter, inkludert smittetesting av donorer av celler og vev, fordelt på følgende åtte klinikker:
- Hjerte- lunge og karklinikken
- Klinikk for hode, hals og rekonstruktiv kirurgi
- Klinikk for kirurgi, inflammasjonsmedisin og transplantasjon
- Klinikk for laboratoriemedisin
- Kreftklinikken
- Kvinneklinikken
- Nevroklinikken
- Ortopedisk klinikk
Godkjenningene er gitt av Helsedirektoratet etter forskrift om håndtering av humane celler og vev, og omfanget er beskrevet i de følgende punktene for hver enkelt avdeling/enhet. Under tilsynet ble OUS bedt om å undersøke om de, utover den godkjente aktiviteten, også håndterer andre typer celler og vev som faller inn under forskrift om håndtering av humane celler og vev og krever godkjenning fra Helsedirektoratet. Helseforetaket har i sin skriftlige egenrapport til Helsetilsynet opplyst at dette ikke er tilfelle.
6.2.2 Hjerte- lunge og karklinikken
6.2.2.1 Thoraxkirurgisk avdeling
OUS har godkjenning og ansvarlig person for «Donasjon, uttak, konservering, oppbevaring, koding, merking og distribusjon av humane aortarøtter og lungearterier beregnet for transplantasjon til mennesker». Aktiviteten er lagt til thoraxkirurgisk avdeling (TKA) på Rikshospitalet.
Aortarøtter og lungearterier er definert som humane celler og vev (graft). Donasjon og uttak skjer i forbindelse med organdonasjon. TKA har etablert rutiner og retningslinjer for å etterleve kravene i forskrift om håndtering av humane celler og vev:
- Samtykke blir innhentet, og donor utredes i forbindelse med organdonasjon. Resultatene fra utførte smittetester av donor blir kontrollert.
- Helseforetaket har inngått skriftlig avtale med Vävnadsbanken i Lund, Sverige. Donorhjerter som ikke kan benyttes til hjertetransplantasjon blir ev. sendt til Vävnadsbanken i Lund som klipper ut, preparerer graft og tildeler Single European Code (SEC). OUS kan ved behov bestille graft fra Lund. Utvekslingen er basert på en altruistisk «bytteordning» som forutsetter at avtaleparter bidrar med donert humant materiale.
- Rutiner og retningslinjer for bestilling, mottak, oppbevaring og bruk av graft fra Lund er beskrevet i helseforetakets elektroniske kvalitetshåndbok.
- Preparerte graft oppbevares i nitrogentank både under transport og ved lagring. TKA leier plass for lagring i nitrogentank på avdeling for immunologi og transfusjonsmedisin. Nitrogennivået i tanken blir overvåket.
- Mottak og bruk av graft blir dokumentert manuelt i egne permer. TKA har egen lagerliste og rydder en gang i året.
- Journal for bruk av graft skannes i elektronisk pasientjournal, kopi blir sendt til Lund. Dokumentasjonen gir sporbarhet donor-mottaker og omvendt via SEC.
- Involvert personell er kjent med rutiner og retningslinjer og leser prosedyrer i e-Håndbok en gang i året, eller ved oppdatering.
- Manuelle opplæringsplaner foreligger.
- TKA gjennomgår aktiviteten årlig og årsrapport utarbeides som en del av den samlede rapporteringen for organdonasjon og transplantasjon.

6.2.3 Klinikk for hode, hals og rekonstruktiv kirurgi
6.2.3.1
OUS har godkjenning og ansvarlig person for «Donasjon, uttak, konservering, oppbevaring, koding, merking, bearbeiding og distribusjon av hornhinner, sclera, tarsus, amnionhinner, epitelceller, slimhinneceller og nerveceller beregnet til bruk ved øyesykdommer og skader hos mennesker. Innførsel av hornhinner og sclera fra San Diego Eye Bank, USA». Aktiviteten er lagt til Senter for øyeforskning ved øyeavdelingen, Ullevål sykehus (Norsk hornhinnebank, heretter hornhinnebanken)
Etter en samlet vurdering av tidligere tilsynsfunn, og innhentet informasjon ved dette tilsynsbesøket, besluttet Helsetilsynet at det var tilstrekkelig å undersøke aktiviteten ved hornhinnebanken ved gjennomgang av mottatt dokumentasjon.
Hornhinnebanken har etablert rutiner og retningslinjer for å etterleve kravene i forskrift om håndtering av humane celler og vev og har opplyst og dokumentert følgende:
- Hornhinnebanken utarbeider omfattende årsrapporter som rettes mot «samarbeidspartnere i arbeidet rundt hornhinnedonasjon, helsepersonell, ledelse ved helseforetak og sykehus, samt norske myndigheter». Årsrapportene er offentlig tilgjengelige, og rapporten for 2020 er sendt Helsedirektoratet.
- I 2020 realiserte hornhinnebanken 95 hornhinnedonasjoner ved OUS og Akershus universitetssykehus (samarbeidspart). 188 donorhornhinner ble preparert ved hornhinnebanken og av disse ble 122 distribuert til transplantasjon ved øyeavdelingen, OUS.
- Donorhornhinner blir kodet og merket med europeisk kode (SEC).
- Hornhinnebanken kontrollerer og registrer jevnlig temperatur i fryser, kjøleskap og varmeskap for oppbevaring av hornhinner, øyevev og amnionhinne.
- Hornhinnebanken håndterer avvik og uønskede hendelser via helseforetakets elektroniske avvikssystem og Biovigilans.
- Hornhinnebanken har ikke registrert feil og hendelser som har blitt vurdert som avvik siste to år knyttet til smittetesting av hornhinner, sclera, tarsus, amnionhinner, epitelceller, slimhinneceller og nerveceller.
- Helseforetaket har gjennomført internrevisjon de siste to år for håndtering av hornhinner, sclera, tarsus, amnionhinner, epitelceller, slimhinneceller og nerveceller. Revisjon 2021 er under gjennomføring.
6.2.4 Klinikk for kirurgi, inflammasjonsmedisin og transplantasjon
6.2.4.1 Avdeling for transplantasjonsmedisin
OUS har godkjenning og ansvarlig person for «Donasjon, uttak, konservering, oppbevaring, koding, merking og distribusjon av humane bekkenarterier og vener beregnet for transplantasjon til mennesker». Aktiviteten er lagt til avdeling for transplantasjonsmedisin på Rikshospitalet.
Bekkenarterier og vener er definert som humane celler og vev. Donasjon og uttak skjer i forbindelse med organdonasjon og uttak av bukorganer. Avdeling for transplantasjonsmedisin har etablert rutiner og retningslinjer for å etterleve kravene i forskrift om håndtering av humane celler og vev.
Avdelingen har opplyst og dokumentert følgende:
- Forrige tilsyn er fulgt opp og helseforetaket har fått godkjenning for håndtering av humane bekkenarterier og vener.
- Det er utarbeidet skriftlige prosedyrer i elektronisk kvalitetshåndbok for uttak, merking, sporbarhet og oppbevaring av arterier og vener (kar).
- Det fremgår at «uthenting av kar gjøres etter aseptiske prinsipper» ved at det benyttes steril, dobbel oppbevaringsboks, og sterilt utstyr når arterier og vener legges i, eller tas ut av oppbevaringsboksen.

- Arterier og vener blir oppbevart i «organkjøleskap» med temperaturalarm. Uttak og oppbevaring blir dokumentert manuelt i permer «på organskapet». Kjøleskapet er plassert i et forberedelsesrom mellom avdelingens operasjonsstuer.
- Involvert personell tar prøver til bakteriologisk undersøkelse av oppbevaringsløsningen (perfusjonsvæsken) hver gang boksen åpnes og ved utløp etter 14 dager.
- Involvert personell er kjent med rutiner og retningslinjer og leser prosedyrer i e-Håndbok en gang i året, eller ved oppdatering.
- Avdeling for transplantasjonsmedisin gjennomgår aktiviteten årlig og årsrapport utarbeides som en del av den samlede rapporteringen for organdonasjon og transplantasjon.
6.2.5 Klinikk for laboratoriemedisin
6.2.5.1 Det norske benmargsgiverregisteret
OUS har godkjenning og ansvarlig person for «Donasjon, oppbevaring, koding og distribusjon av humane hematopoietiske stamceller beregnet på allogen stamcelletransplantasjon (inkludert lymfocyttinfusjon) til mennesker, samt overføring av slike stamceller til og fra land utenfor EØS-området». Aktiviteten ved Det norske benmargsgiverregisteret (BMGR) er lagt til avdeling for immunologi og transfusjonsmedisin på Rikshospitalet.

BMGR orienterte om egen aktivitet under tilsynsbesøket og presenterte blant annet følgende:
- Registeret har som formål å bygge opp og vedlikeholde et register over givere til bruk for pasienter som har behov for stamcelletransplantasjon og ikke har egnet familiegiver. Rekruttering av mulige givere skjer i samarbeid med norske blodbanker, og med blodbanken på Island.
- Registrerte givere tildeles en unik kode (GRID).
- Registeret har i 2021 i ca. 35000 HLA-typede aktive givere.
- Involvert personell koordinerer benmargs- og stamcelledonasjoner, følger opp givere i forkant av donasjoner og kontrollerer at virustester er utført og negative.
- Registeret deltar i et utstrakt europeisk samarbeid om kontrakter med kurérselskap for transport av stamceller over landegrenser. Helsetilsynet fikk opplyst at bruk av erfarne kurerer hadde vist seg avgjørende for utveksling av stamceller over landegrenser ved reiserestriksjoner under pandemien.
- Søk etter egnede donorer skjer oftest internasjonalt, og BMGR har etablert prosedyre for import fra land utenfor EU/EØS.
- Registeret har inngått avtaler med de beinmargsregistrene de oftest samarbeider med for å finne egnede donorer til norske pasienter, NMPD (det store registeret i USA), Australian Bone Marrow Registry og One Match (det største registeret i Canada)
- HLA-typing av donorer ved rekruttering ble på tidspunktet for tilsynet utført ved et oppdragslaboratorium i USA etter et felles europeisk anbud. Detaljert eller bekreftende HLA-typing i forbindelse med mulig donasjon, eller annen transplantasjonsimmunologisk utredning, blir utført ved seksjon for transplantasjonsimmunologi på IMM, OUS.
- Det foreligger en oversikt over benmargsgiverregisterets samarbeidspartnere.
- Involvert personell registrerer og følger opp avvik.
- Helseforetaket gjennomfører jevnlige internrevisjoner ved BMGR, Helsetilsynet har mottatt rapport fra internrevisjon datert 22. desember 2020 med tema «Kjerneprosess: Benmargsgiverregisteret - fra rekruttering til donasjon».
6.2.5.2 Ex-vivo cellelaboratoriet
OUS har godkjenning og ansvarlig person for «Konservering, oppbevaring, merking, bearbeiding og distribusjon av humane bruskceller, beinmargceller, blæreceller og erytrocytter beregnet på bruk til mennesker». Aktiviteten er lagt til Ex-Vivo cellelaboratorium ved avdeling for immunologi og transfusjonsmedisin på Rikshospitalet.
Seksjon for Ex-vivo cellelaboratorium (cellelaboratoriet) mottar og dyrker celler fra pasienter ved andre enheter/avdelinger på OUS, og i enkelte tilfelle fra eksterne virksomheter. Produktet er beregnet for senere tilbakeføring til samme pasient (autolog transplantasjon). Legemiddelverket har tilsynsansvar for dyrking av celler i cellelaboratoriet.
Involvert personell ved cellelaboratoriet orienterte om egen aktivitet under tilsynsbesøket og presenterte blant annet følgende:
- Cellelaboratoriet har utarbeidet skriftlige prosedyrer i elektronisk kvalitetshåndbok for kjerneprosessene.
- Mottatte celler og vev skal være merket med navn og fødselsnummer. Opplysningene blir kontrollert mot folkeregisteret.
- Resultatene fra utførte smittetester av donor blir kontrollert.
- Produkt som distribueres blir merket med europeisk kode (SEC).
- Cellelaboratoriet utfører bakteriologisk kontroll av inkubatorer og produkter. I tillegg blir batch-kontroll dokumentert for å sikre sporbarhet til produkter og materialer.
- Det foreligger tredjepartsavtale for transport av celler og vev.
- Opplæringsrutiner foreligger, og gjennomført opplæring blir dokumentert
- Cellelaboratoriet utfører jevnlig og dokumentert vedlikehold på utstyr.
- Cellelaboratoriet registrerer og følger opp avvik. Helsetilsynet fikk presentert hvordan cellelaboratoriet hadde håndtert avvik som var registrert.
- Det gjennomføres jevnlige internrevisjoner. Siste revisjon ble gjennomført i mai 2021 med tema «Kjerneprosess. Autologe kondrocytter». Revisjonsrapport foreligger.
6.2.5.3 Avdeling for mikrobiologi
OUS har to godkjenninger for «Testing av donorer av celler og vev». Aktivitetene som er omfattet av godkjenningene er lagt til avdeling for mikrobiologi og lokalisert på henholdsvis Ullevål sykehus og Rikshospitalet. De to godkjente enhetene har én ansvarlig person etter forskrift om håndtering av humane celler og vev. Avdelingen er akkreditert etter ISO 15189.
Etter en samlet vurdering av tidligere tilsynsfunn, og innhentet informasjon ved dette tilsynsbesøket, besluttet Helsetilsynet at det var tilstrekkelig å undersøke aktiviteten ved avdeling for mikrobiologi ved gjennomgang av mottatt dokumentasjon.
Avdeling for mikrobiologi har etablert rutiner og retningslinjer for å etterleve kravene til smittetesting av donorer i forskrift om håndtering av humane celler og vev. Laboratoriene har ikke pasientkontakt og mottar prøvemateriale fra virksomheter som rekrutterer og vurderer egnetheten for donorer av celler og vev.
Avdelingen har opplyst og dokumentert følgende:
- Årsrapport for utført smittetesting av donorer av celler og vev er utarbeidet for 2020 og sendt Helsedirektoratet.
- Laboratoriene har ikke registrert avvik siste to år knyttet til smittetesting av humane celler og vev.
- Helseforetaket har gjennomført internrevisjon siste to år med smittestesting av donorer av celler og vev som tema og utarbeidet en revisjonsplan for de neste to årene.
6.2.6 Kreftklinikken
6.2.6.1 Avdeling for kreftbehandling, seksjon for celleterapi
OUS har godkjenning og ansvarlig person for «Donasjon, uttak, konservering, oppbevaring, merking, bearbeiding og distribusjon av humane hematopoietiske stamceller, perifere stamceller, stamceller fra beinmarg, andre typer celler høstet fra blod, langerhanske øyceller til autolog og allogen bruk på mennesker, samt celler fra navlestrengsblod, morkake celler og vev og morkake deriverte celler». Aktiviteten er lagt til seksjon for celleterapi ved avdeling for kreftbehandling på Radiumhospitalet.
Seksjon for celleterapi produserer celleterapiprodukter til flere avdelinger/enheter ved OUS og har i tillegg utstrakt forskningsvirksomhet. Legemiddelverket har tilsynsansvar for selve produksjonen av celleterapiprodukter.
Etter en samlet vurdering av tidligere tilsynsfunn, avgrenset tilsynsansvar for Helsetilsynet og innhentet informasjon ved dette tilsynsbesøket, besluttet vi at det var tilstrekkelig å undersøke relevant aktivitet ved seksjon for celleterapi ved gjennomgang av mottatt dokumentasjon.
Avdelingen har opplyst og dokumentert følgende:
- Seksjonen høster stamceller fra perifert blod ved hjelp av afereseteknikk og samarbeider tett med benmargsgiverregisteret ved utredning og høsting av ubeslektede allogene beinmargsgivere.
- Ansvarlig person og stedfortreder for denne etter forskrift om håndtering av humane celler og vev er endret siden forrige tilsyn, begge har arbeidet ved seksjonen i lengre tid.
- Det foreligger årsrapport for håndtering av stamceller i 2020.
6.2.7 Kvinneklinikken
6.2.7.1 Reproduksjonsmedisinsk avdeling, seksjon laboratorieenheten
OUS har godkjenning for «Donasjon, uttak, konservering, oppbevaring, koding, merking, bearbeiding og distribusjon (innenfor og utenfor EU/EØS) av celler og vev beregnet til bruk ved assistert befruktning hos mennesker» etter forskrift om håndtering av humane celler og vev. Aktiviteten er lagt til reproduksjonsmedisinsk avdeling (RMA) og lokalisert både på Rikshospitalet og Ullevål sykehus. Avdelingen har høy aktivitet og som eksempel kan nevnes at det i 2020 ble gjennomført tilbakeføring av 2089 embryo (ferske og tinte).
Godkjenning av celler og vev beregnet for assistert befruktning må ses i sammenheng med godkjenning etter bioteknologiloven. OUS oppgir å ha slike godkjenninger for aktuelle metoder for assistert befruktning, drift av sædbank (donorsæd/ikke partner). Helsetilsynet har fått forelagt godkjenning for vurdering av par og kvinner for preimplantasjonsdiagnostikk (PGD) og tilby PGD ved kjøp av tjenesten i utlandet. I tillegg er reproduksjonsmedisinsk avdeling registrert som behandlingsbiobank.
RMA ivaretar også oppgavene knyttet til helseforetakets nasjonale ansvar for fertilitetsbevarende behandling med autologt ovarialvev og behandling med assistert befruktning til par med HIV- eller hepatittsmitte (egen laboratorieenhet på Ullevål), jf. rapportens kapittel 4. I forbindelse med at helseforetaket etablerte et nasjonalt behandlingstilbud til par med HIV- eller hepatittsmitte i 2018 ble den ordinære driften ved IVF-laboratoriet på Ullevål flyttet til laboratorieenheten på Rikshospitalet.
Dette tilsynet er avgrenset til aktiviteten ved laboratorieenheten ved reproduksjonsmedisinsk avdeling, Rikshospitalet.
Generelt inntrykk:
Ved gjennomgang av mottatt dokumentasjon og ved intervjuer og befaring under tilsynsbesøket har avdeling for reproduksjonsmedisin opplyst og dokumentert at:
- Opplæring av involvert personell ved laboratorieenheten blir planlagt, gjennomført og dokumentert manuelt ved hjelp av sjekklister.
- Det foreligger oppdatert oversikt over fordeling av oppgaver og ansvar i dokumentet «Organisasjon ved Reproduksjonsmedisinsk avdeling» (29. oktober 2021).
- Avdelingen har etablert skriftlige prosedyrer i elektronisk kvalitetshåndbok.
- Involvert personell registrerer og følger opp avvik.
- Det foreligger plan for internrevisjoner ved kvinneklinikken. Siste rapport med tilhørende handlingsplan fra RMA er datert 7. november 2019.
Lokaler og utstyr:
- Under befaring ved laboratorieenheten/IVF-laboratoriet fremsto laboratorielokalet som maksimalt utnyttet, med mange støvsamlende flater, og det var mange ansatte tilstede i laboratoriet i forhold til areal.
- Gjennomført internrevisjon i 2019 påpeker uregelmessighet ved kontroll av luftkvaliteten i laboratoriet ved partikkeltelling.
- Mottatt dokumentasjon (rapporter) for partikkeltelling og CFU-måling (bakteriemåling) utført i 2021 viser at flere av rapportene er ikke godkjent/signert ved OUS. OUS har i tilbakemeldingen på foreløpig rapport vedlagt signerte rapporter.
- Helsetilsynet har mottatt forslag til avtale med ekstern leverandør om kontroll av luftkvalitet. Avtaleutkastet er fra 2018 og er ikke signert fra OUS. Signert avtale kunne ikke fremlegges under tilsynsbesøket. Helsetilsynet fikk opplyst at kontroller i henhold til avtalen var utført i praksis. Helsetilsynet mottok signert kontrakt datert 25. november 2021 ved tilbakemelding på foreløpig rapport.
- Tekniske avvik meldes i elektronisk avvikssystem. Feil ved instrumentet «Sperm analyser» er registrert som avvik, men ikke rettet. Helsetilsynet fikk opplyst at ved mistanke om feil resultat kompenserer involvert personell ved manuell telling og vurdering. Instrumentet for spermanalyser er i etterkant av tilsynet blitt vedlikeholdt og reparert, og OUS har i forbindelse med tilbakemeldingen på rapporten vedlagt signert valideringsrapport.
- Avdelingens nitrogentanker med egg, sæd og embryo ved laboratorieenheten på Rikshospitalet er plassert i samme rom. Rommet var ikke låst. I tilbakemelding på foreløpig rapport har OUS opplyst til Helsetilsynet at «Døren til biobankrommet står åpen når ingeniør jobber inne som beskyttelsestiltak pga mangel av vindu på døren. Ansatte lab. seksjonen har blitt informert til å lukke døren når ingen arbeid utføres i rommet. Det er kun ansatte ved RMA og sikkerhetsavdeling på sykehus som har tilgang til rommet ved ID-kort.»
- Nitrogentankene etterfylles med nitrogen fra påfyllingstanker for å sikre at lagrede celler ikke tiner og ødelegges. Påfyllingstankene må byttes manuelt. Nye nitrogentanker er plassert i korridor.

Dokumentasjon av feil/hendelser og av utført vedlikehold
RMA har valgt å ta i bruk en kjøpt applikasjon (Trello) og tilpasset denne til bruk for dokumentasjon av feil/hendelser og av utført vedlikehold av instrumenter og utstyr i avdelingen:
- Involvert personell har tilgang til applikasjonen fra private mobiler og fra PC.
- Applikasjonen brukes blant annet til å registrere feil/avvik i laboratoriet («grønne korset») og ved kvittering på sjekklister for vedlikehold.
- Risikoanalyse for bruk av applikasjonen, eksempelvis med tanke på risiko knyttet til personvern, datasikkerhet mv. ved avdelingen, kunne ikke fremlegges. OUS har i sin tilbakemelding på foreløpig rapport vedlagt risikoanalyse for bruk av Trelloapplikasjonen som er gjennomført i etterkant av tilsynet.
Sporbarhet og registrering av sporbarhetsopplysninger:
- Reagenser/medier som benyttes ved laboratorieenheten blir registrert manuelt. Denne rutinen gir sporbarhet til dato/hele dager. Ved bytte av reagens/medium i løpet av en arbeidsdag foreligger det ikke fullstendig sporbarhet.
- Dokumentasjon av utførte oppgaver ved håndtering av egg, sæd og embryo i IVF-lab skjer manuelt på egne skjema. Dokumentasjonen skannes i etterkant i elektronisk pasientjournal (DIPS). Delvis overlappende dokumentasjon blir registrert i et eget datasystem (Invitro).
- Protokoll/donorbok føres manuelt og gir oversikt over inseminering/IVF med donorsæd og inneholder sporbarhet mellom mor og donorkode. Donorbok i bruk er tilgjengelig for flere, ferdig utfylte bøker låses inn i et arkiv.
- Mor-donorkode føres over i en elektronisk tabell lagret på «K-sensitiv». Helsetilsynet fikk opplyst at kun én person har tilgang til registrerte opplysninger i elektronisk tabell.
- «Valglister» og donorlister med utvalg av tilgjengelige donorer, oversikt over antall ganger donor var benyttet, og oversikt over mottakere, lå tilgjengelig under tilsynsbesøket.
Validering av nytt og reparert utstyr:
- RMA har utarbeidet prosedyren «Validering og vedlikehold av utstyr - IVF laboratorium».
- Prosedyren angir at «validering utføres ved enkel testing av utstyrets funksjonalitet. Det må videre påvises at «utstyret holder innenfor kritiske parametre, slik som temperatur for inkubator. Utført validering må dokumenteres på eget skjema». OUS har i sin tilbakemelding på foreløpig rapport vedlagt valideringsrapport for inkubator som har blitt utarbeidet i etterkant av tilsynet.
- Helseforetaket kunne under tilsynsbesøket ikke fremlegge valideringsrapporter for utstyr i bruk ved laboratorieenheten. Servicerapporter fra leverandør foreligger.
Ledelse og kvalitetsforbedring
- OUS har fått utført «Risikoanalyse - bruk av flytende nitrogen, mai 2019» som identifiserte flere risikoområder, blant annet:
- «sikkerhetsventiler blåser daglig 5-10 sekunder
- stort støynivå
- oksygennivå har vist verdi på 19,5%».
Analysen ble utført av en innleid part med kompetanse på området. Helsetilsynet er forelagt analyserapporten.
På tidspunktet for tilsynsbesøket var det ikke iverksatt forbedringstiltak etter anbefalinger i analysen, hverken for påfylling av tanker med egg, sæd og embryo, eller for plassering av nitrogentanker.
- Helsetilsynet har fått opplyst at helseforetaket har vurdert laboratorieenhetens lokaler på Rikshospitalet som lite egnet. Endringer er ikke gjennomført.
- Ansvarlig person og stedfortreder er endret og melding sendt til Helsedirektoratet. Gyldig godkjenning forelå ikke på tidspunktet for tilsynsbesøket. OUS har i sin tilbakemelding på foreløpig rapport vedlagt Helsedirektoratets godkjenning av ansvarlig person og stedfortreder hos RMA datert 24. november 2021.
- Under tilsynsbesøket fremsto det uklart hvem som var ansvarshavende for behandlingsbiobanken.
- OUS har retningslinjer for internrevisjon. Siste internrevisjon Helsetilsynet har opplysninger om ved RMA ble utført i 2019 med tema «biobanken». Påpekte forhold er avsluttet ved å melde fra i linjen – praksis var ikke korrigert på tidspunktet for tilsynsbesøket. I tilbakemelding på foreløpig rapport har helseforetaket vedlagt Kvinneklinikkens plan for interne revisjoner oppdatert per januar 2022. Planen viser at utvalgte team ved RMA er planlagt revidert inneværende år.
- RMA har skriftlige retningslinjer og prosedyrer. Noen av disse er også oversatt til engelsk. Avdelingen har ansatte som behersker norsk språk i varierende grad. Helsetilsynet er ikke kjent med at kvalitet og sikkerhet i laboratoriet ved eventuelle språkbarrierer har vært tema ved eksempelvis internrevisjoner.
Kvinneklinikkens tilbakemeldinger på foreløpig rapport
Som en del av helseforetakets tilbakemelding på foreløpig rapport har Kvinneklinikken lagt ved et eget notat. Notatet viser har klinikken allerede har rettet opp enkelte forhold. Dokumenterte korrigerende tiltak som allerede er gjennomført, er kommentert under tilhørende punkter over.
Videre beskriver kvinneklinikken prosjekter og tiltak som er under utredning og/eller planlagt. Dette gjelder blant annet:
- «Trello applikasjonen skal erstattes med Teams-Planer applikasjon som er anbefalt fra Helse Sør-Øst»
- arbeid med å få på plass et elektronisk «witnessystem» som sikrer sporbarhet på reagenser/medier
- prosess med å introdusere DIPS-Arena som skal erstatte InVitro. Systemet planlegges å være implementert i RMA i løpet av første kvartal 2022. Manuelle skjema som brukes i dag vil da bli erstattet med digital registrering
- dokumentskap (verdiskap) med brannbeskyttelse og LCD-kodelås er bestilt for oppbevaring av bøker og permer som inneholder sensitive opplysninger, donorkoder, donorlister og sporbarhet mellom mor og donorkode.
- prosedyre for validering («Validation Master Plan») er under arbeid
- seksjon laboratorieenheten arbeider med å få på plass alle valideringsrapporter for utstyr i bruk ved laboratorieenheten.
OUS har videre opplyst at
- pågående prosjekt for utflytting og samling av RMA vil sikre at laboratoriet har størrelse og ventilasjon som er tilpasset avdelingens aktivitet og relevante krav. Videre vil planlagte nye lokaler ta høyde for en økning av aktiviteten i forbindelse med ny bioteknologilov.
- RMA utførte en risikoanalyse vedrørende språk 7. januar 2022 og vil gjennomføre internrevisjon med fokus på språkbarrierer. Videre opplyses det at møter i seksjonen avholdes på engelsk og videreformidling av informasjon skjer på både norsk og engelsk. Alle ansatte i seksjonen deltar på norskkurs.
6.2.7.2 Fødeavdelingen
I forbindelse med fødsel er det mulig å tappe blod fra navlestrengen og/eller ta ut navlestrengsvev for oppvaring. Det mest vanlige er høsting av autologt navlestrengsblod og -vev uten medisinsk indikasjon på forespørsel fra familier. Familiene har da inngått avtale med kommersielle aktører om lagring av stamceller fra navlestrengsblod og -vev med tanke på senere bruk til barnet (autologt), og har ved fødsel med en pakke med utstyr til høsting av dette.
Helse- og omsorgsdepartementet har gitt retningslinjer som legger til grunn at foreldre ikke skal nektes å tappe og deretter lagre navlestrengsblod ved private navlestrengsblodbanker dersom de ønsker det. Dette forutsatt at høsting ikke er til fare for mor og barn.
Fødeavdelingen ved OUS tillater tapping av navlestrengsblod dersom foreldrene har inngått avtale med en kommersiell navlestrengsblodbank:
- Helsetilsynet fikk opplyst at det på tidspunktet for tilsynet var lenge siden fødeavdelingen hadde fått forespørsel om dette.
- Rutinen ble oppgitt å være at firmarepresentant bør tappe selv, og at fødeavdelingen legger til rette ved å bringe morkake med navlestreng til avdelingens skyllerom der tappingen kan forgå.
I tillegg tapper fødeavdelingen navlestrengsblod på medisinsk indikasjon:
- Tapping på medisinsk indikasjon utføres i samarbeid med seksjon for celleterapi.
- Fødeavdelingen har prosedyre som beskriver dette samarbeidet og fremgangsmåte for høsting. Seksjon for celleterapi har godkjenning for håndtering av navlestrengsblod.
- Helseforetaket har ikke gjennomført internrevisjon med høsting av navlestrengsblod som tema.
6.2.8 Nevroklinikken
6.2.8.1 Nevrokirurgisk avdeling
OUS har godkjenning for «Uttak, prosessering, emballering, merking og oppbevaring av benlapper beregnet til autolog transplantasjon hos mennesker». Aktiviteten er lagt til nevrokirurgisk avdeling, Ullevål sykehus og Rikshospitalet.
Nevrokirurgisk avdeling tar ut kranie-benlapper og oppbevarer disse for ev. senere tilbakesetting (autolog bruk).
Helsetilsynet fikk opplyst og dokumentert:
- Avdelingen tar ut 10-20 kranielapper totalt per år i forbindelse med behandling av pasienter med behov for nevrokirurgisk intervensjon ved økt intrakranielt trykk/hjerneødem. Etter uttak blir benlapper rengjort, pakket sterilt, merket med uttaksdato og navn/fødselsnummer.
- Benlappene oppbevares i frysere på operasjonsavdelingene ved begge lokasjoner. Frysere er koblet til alarm. Sykepleier med ansvar for fryserne rydder månedlig og kaster ev, benlapper som ikke skal benyttes.
- Avdelingen har utarbeidet brukerveiledning for «Beinfryser» og skriftlig prosedyre for «Behandling av Cranie-benlapp ved autotransplantasjon».
- Sykepleier på operasjonsavdelingen holder internundervisning om håndtering av benlapper.
- Helseforetaket hadde på tidspunktet for tilsynsbesøket ikke oppdatert/meldt inn ny ansvarlig person for aktiviteten.
- Avdelingen utarbeider årsrapport og oppdaterer prosedyrer i e-Håndbok jevnlig.
6.2.9 Ortopedisk klinikk
6.2.9.1 Ortopedisk avdeling
OUS har godkjenning og ansvarlig person for «Donasjon, uttak, konservering, merking og oppbevaring av humant bein- og senevev beregnet til allogen transplantasjon hos mennesker. Godkjenningen omfatter også import av menisk- og senegraft fra AlloSource, USA» Aktiviteten er lagt til Ortopedisk avdeling, Ullevål sykehus og legevakten. På tidspunktet for tilsynsbesøket forelå det i tillegg en godkjenning for «Donasjon, uttak, oppbevaring, merking og distribusjon av humane bruskceller beregnet til autolog transplantasjon på mennesker» knyttet til «Ortopedisk senter».
Helsetilsynet fikk ved tilsynsbesøket ved legevakten opplyst og dokumentert:
- Avdelingen koder og merker høstet bein- og senevev med Single European Code (SEC).
• Donorer blir smittetestet både serologisk og med PCR-teknikk. - Aktiviteten blir gjennomgått i forbindelse med årsrapportering.
- Ved import av menisk- og senevev fra USA blir materialet merket med europeisk kode og utført mottakskontroll blir dokumentert.
- Helseforetaket har skriftlige avtaler med eksterne leverandører av humant bein- og senevev.
- Ulike donerte sener blir plassert i fryser etter fargekoder for god oversikt i fryser ved senere transplantasjon.
- Fryser på legevakten var tydelig merket med «karantene» og «frigitt vev» og den var koblet med alarm til døgnvakt.

6.2.10 Ledelse og kvalitetsforbedring
OUS har utarbeidet fellesdokumentet/nivå 1 – «Retningslinje - Celler og vev - krav til kvalitet og sikkerhet ved håndtering av humane celler og vev». Hensikten med retningslinjen er oppgitt å være (Dokument-ID 47578 versjon 8):
- «å veilede aktuelle enheter ved Oslo universitetssykehus i henhold til Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev.» Retningslinjen angir ansvar og oppgaver på de ulike ledernivåene for helseforetakets aktivitet knyttet til håndtering av humane celler og vev. I tillegg beskrives ansvar lagt til ansvarlige personer etter forskriften § 6, og det angis at «Alle ansatte ved sykehuset som omfattes av virkeområdet for forskriften skal forholde seg til denne retningslinjen. Dette gjelder uavhengig av organisatorisk plassering, yrkesgruppe og forskningsområde.»
Helsetilsynet har innhentet informasjon og dokumentasjon som viser følgende: - Helseforetaket hadde på tidspunktet for tilsynet ikke fullstendig oversikt over foreliggende godkjenninger etter forskrift om håndtering av humane celler og vev og etter bioteknologiloven. Gjennomgang i forbindelse med tilsynet viste at OUS har godkjenning for kjent aktivitet knyttet til håndtering av celler og vev.
- Godkjenningene ved enkelte av virksomhetene var ikke fulgt opp og oppdatert etter forrige tilsyn (2017)
o For «Senter for ortopedi», håndtering av brusk, er oppgitt ansvarlig person ikke lenger ansatt ved OUS, og aktiviteten er dekket av annen godkjenning.
o For nevrokirurgisk avdeling, kranielapper, er ny ansvarlig person utpekt i praksis – endringen var på tidspunktet for tilsynsbesøket ikke meldt Helsedirektoratet.
o Reproduksjonsmedisinsk avdeling har endret ansvarlig person og stedfortreder. På tidspunktet for tilsynsbesøket var endringene meldt Helsedirektoratet, men foreløpig ikke godkjent. - Helseforetaket har ikke fulgt opp at nye ansvarshavende for behandlingsbiobanker blir registrert i Biobankregisteret (Folkehelseinstituttet).
- Godkjenninger og årsrapporter for håndtering av humane celler og vev har ikke vært tema på ledelsens gjennomgang siste to år.
6.3 Helsetilsynets vurdering - håndtering av humane celler og vev
6.3.1 Generelt inntrykk
Oslo universitetssykehus har ansvaret for håndtering av humane celler og vev beregnet til bruk på mennesker innenfor flere ulike fagområder. Aktiviteten er organisert under åtte klinikker, og årsrapportene fra de godkjente enhetene viser at aktivitetsnivået er svært varierende.
Helsetilsynet vurderer at involvert personell ved de ulike enhetene/avdelingene som håndterer celler og vev beregnet for bruk på mennesker bruker tid og ressurser på å planlegge, gjennomføre, evaluere og ev. korrigere aktiviteten for å ivareta pasientsikkerheten for donorer og mottakere. Gjennomgang av innhentede opplysninger og dokumentasjon viste at nødvendige godkjenninger forelå og at håndtering av celler og vev i hovedsak ble gjennomført i tråd med kravene i forskrift om håndtering av humane celler og vev.
6.3.2 Helseforetakets oppfølging ved håndtering av humane celler og vev
For å ivareta pasientsikkerheten for donorer og mottakere av celler og vev, blant annet ved å sikre etterlevelse av kravene i forskrift om håndtering av humane celler og vev, har helseforetaket etablert overordnede retningslinjer for håndtering av humane celler og vev. Helsetilsynet vurderer at ledelsen ved helseforetaket ikke i tilstrekkelig grad har fulgt opp at retningslinjene er blitt implementert på de ulike ledernivåene eller i enhetene/avdelingene som håndterer celler og vev. I tillegg vil vi påpeke at OUS har et overordnet ansvar for å sikre at alle enheter som håndterer celler og vev settes i stand til å etterleve kravene i forskriften, spesielt etter endringer og uavhengig av størrelse og aktivitetstall.
6.3.3 Helseforetakets oppfølging av håndtering av egg, sæd og embryo beregnet til assistert befruktning
Oslo universitetssykehus har siden helseforetaket ble etablert i 2008 gjennomført flere endringer i behandlingstilbudet ved assistert befruktning, eksempelvis for å kunne etablere et forsvarlig behandlingstilbud til par med HIV- og hepatittsmitte. Endringene er utført innenfor de eksisterende lokalene på Rikshospitalet og Ullevål sykehus og har ført til at laboratorieenheten på Rikshospitalet fremstår som maksimalt utnyttet. Helseforetaket har ved internrevisjon ved avdeling for reproduksjonsmedisin i 2019 selv påpekt at «biobanken er plassert i et trangt og lite egnet lokale midt i avdelingen».
Helsetilsynet vil påpeke at helseforetaket har plikt til å sørge for korrigerende tiltak som bidrar til forsvarlig håndtering og lagring av egg, sæd og embryo. I sin tilbakemelding på foreløpig rapport har helseforetaket vedlagt et notat fra reproduksjonsmedisinsk avdeling. I notatet vises det blant annet til et pågående prosjekt for å finne egnede lokaler til avdelingen. Helsetilsynet vil påpeke at OUS, i påvente av flytting til mer egnede lokaler, har plikt til å evaluere om de eksisterende lokalene ved reproduksjonsmedisinsk avdeling er egnet til å etterleve endringene i bioteknologiloven der det blant annet åpnes for utvidet lagring av embryo. Vi viser også til vår redegjørelse under punkt 6.2.7 ovenfor.
Sentrale regler:
Tilsynet med celler, vev og organer har omfattet etterlevelse av både bioteknologiloven og forskrift om håndtering av humane celler og vev. Sentrale krav som tilsynet har lagt til grunn for kontrollen har vært
- krav til godkjenning etter bioteknologilov og forskrift om håndtering av humane celler og vev
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler, vev:
o krav til ledelse, organisering og styring av virksomheten, herunder avtaler med tredjepart
o krav til virksomhetenes lokaler og utstyr mv. ved prosessering
I tillegg har vi sett på forskriftens krav til prosessering, oppbevaring, distribusjon og mottak av celler, vev og organer, krav til sporbarhet, tilbakekall, kvalitet og sikkerhet.
Ettersom tilsynet har omfattet mange aktiviteter og det i liten grad er avdekket avvik omtales ikke reglene ytterligere. Der tilsynet har avdekket brudd på regelverket beskrives kravene som er lagt til grunn nærmere i tilknytning til avviket, jf. punkt 6.4 nedenfor.
6.4 Helsetilsynets konklusjon - håndtering av humane celler og vev
Avvik 1:
Oslo universitetssykehus har etablert en overordnet retningslinje for å veilede aktuelle enheter ved helseforetaket som håndterer humane celler og vev til bruk på mennesker.
Helseforetakets ledelse har ikke i tilstrekkelig grad sikret at alle aktuelle avdelinger/enheter etterlever kravene til kvalitet og sikkerhet ved håndtering av humane celler og vev, har oppdaterte godkjenninger og utpekte ansvarlige personer. Helseforetaket har heller ikke fulgt opp at nye ansvarshavende for behandlingsbiobanker blir utpekt og registrert.
Ledelsens mangelfulle oppfølging kan ha medført redusert pasientsikkerhet ved donasjon og mottak av humane celler og vev.
(S)
Avvik fra følgende krav i forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten:
§ 3 Ansvaret for styringssystem
§ 7 Plikten til å gjennomføre
§ 9 Plikten til å korrigere
Avvik fra følgende krav i forskrift om håndtering av humane celler og vev:
§ 4 Godkjenning og vilkår
§ 6 Ansvarlig person
§ 8 Internkontroll mv
Avvik 2:
Oslo universitetssykehus sikrer ikke i tilstrekkelig grad at kravene til kvalitet og sikkerhet ved håndtering og lagring av egg, sæd og embryo beregnet for assistert befruktning kan etterleves for områdene:
- Skjerming og sikring av sporbarhetsopplysninger
- Lokaler og utstyr
Helsetilsynet anser at ledelsen ved helseforetaket ikke raskt nok og i tilstrekkelig grad har fulgt opp allerede kjent risiko ved håndtering og lagring av egg, sæd og embryo beregnet for assistert befruktning. Helseforetaket har heller ikke sikret egnede systemer for registrering og skjerming av sporbarhetsopplysninger.
(S)
Avvik fra følgende krav i forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten:
§ 3 Ansvaret for styringssystem
§ 6 Plikten til å planlegge
§ 9 Plikten til å korrigere
Avvik fra følgende krav i forskrift om håndtering av humane celler og vev:
§ 10 Generelle krav til utstyr mv
§ 11 Krav til kritisk utstyr
§ 12 Anlegg og lokaler
§ 50 Taushetsplikt
7 Forventninger til virksomheten og videre oppfølging
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 15. juni 2022
- helseforetakets handlingsplan for korrigerende tiltak
- plan for iverksetting og oppfølging av tiltak beskrevet i tilbakemelding på foreløpig rapport
- beskrivelse av hvordan ledelsen ved OUS vil følge opp at iverksatte tiltak fungerer etter hensikten
Med hilsen
Ingerid Helene Herstad Nygaard etter fullmakt
avdelingsdirektør
Tone Blørstad
fagsjef
Brevet er godkjent elektronisk og sendes derfor uten underskrift
Saksbehandler: Tone Blørstad, tlf. 21 52 99 94
Vedlegg:
1 Deltakerliste
2 Dokumentunderlag
3 Program
Kopi til:
Statens legemiddelverk
Helsedirektoratet
Statsforvalteren i Oslo og Viken
Anèe Hvass