Rapport etter tilsyn med håndtering av navlestrengsblod og navlestrengsvev 2021
Oppfølging av tilsynet
Ved dette tilsynet ble det avdekt lovbrudd. Tilsynsmyndigheten har vurdert de tiltakene som er satt i verk som tilstrekkelige. Tilsynet er derfor avsluttet.
Statens helsetilsyn har i perioden 5. januar - 21. april 2021 gjennomført tilsyn med aktiviteten Janne Marsteen, heretter kalt konsulenten, utfører på vegne av Save Stem Cell Center. Tilsynet omfattet håndtering av navlestrengsblod og navlestrengsvev, og ble utført i henhold til forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev.
Gjennom en stedfortrederavtale med Save Stem Cell Center i Danmark er konsulenten ansatt for å utføre oppgaver knyttet til donasjon, uttak, koding, merking og distribusjon av navlestrengsblod og navlestrengsvev. Aktiviteten i Norge er definert som en egen virksomhet der konsulenten er ansvarlig person etter forskrift om håndtering av humane celler og vev.
Hensikten med tilsynet var å undersøke hvordan oppgavene knyttet til håndtering av det humane materialet ivaretas både faglig og styringsmessig, herunder om kravene i forskriften og vilkårene i godkjenning og avtale blir etterlevd.
Tilsynet ble gjennomført ved innhenting og gjennomgang av informasjon og dokumentasjon. I tillegg ble det gjennomført et videomøte med konsulenten 18. februar 2021.
Tilsynet avdekket ett avvik:
Virksomheter som håndterer navlestrengsblod og navlestrengsvev beregnet for oppbevaring og senere autolog bruk skal blant annet sikre sporbarhet for oppsamlet materiale og redusere risikoen for overføring av sykdom via celler og vev. Helsetilsynet vurderer at den aktuelle virksomheten i Norge ikke etterlever kravene som er satt til sporbarhet og til smittetesting av mor før høsting av navlestrengsblod og navlestrengsvev. Videre foreligger det brudd på kravene til avtaler med, og opplæring av, annet involvert helsepersonell.
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 10. juni 2021:
- virksomhetens handlingsplan for korrigerende tiltak, inkludert hva som er implementert og eventuelle frister for implementering av det som ikke er ferdigstilt
- beskrivelse av hvordan virksomheten skal sikre at smittettester av mor utføres ved et laboratorium som er godkjent av Helsedirektoratet for dette formålet, jf. forskrift om håndtering av humane celler og vev, § 17
- beskrivelse av virksomhetens donasjonsregister, jf. forskrift om håndtering av humane celler og vev, § 45
- beskrivelse av hvordan virksomheten skal følge opp at iverksatte tiltak fungerer etter hensikten
Dokumentasjonen sendes som e-post til postmottak@helsetilsynet.no med kopi til etv@helsetilsynet.no
1. Tilsynets tema og innhold
Statens helsetilsyn fører jevnlige tilsyn med håndtering av celler og vev. Tilsynet gjennomføres etter helsetilsynsloven § 1 og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Vi har i dette tilsynet lagt spesielt vekt på hvordan oppgaver knyttet til håndtering av navlestrengsblod og navlestrengsvev ivaretas både faglig og styringsmessig, herunder om kravene i forskriften, og vilkårene i godkjenning og avtale, blir etterlevd.
2. Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer celler og vev etterlever gjeldende lov- og forskriftsbestemmelser.
Lovgrunnlag for tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
Forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i aktuell forskrift.
2.2 Krav til virksomheter som håndterer navlestrengsblod og navlestrengsvev
Donasjon, uttak, koding, merking og distribusjon av navlestrengsblod og navlestrengsvev kan bare finne sted ved virksomheter som er godkjent av Helsedirektoratet for dette formålet. Med virksomhet siktes det til virksomheter som er juridiske personer, det vil si selvstendige rettssubjekter som opptrer utad som en enhet. Begrepet virksomhet kan også benyttes om enkeltpersoner som håndterer humane celler og vev beregnet for bruk på mennesker.
Virksomheter som håndterer humane celler og vev har ansvar for å etterleve kravene som følger av forskrift om håndtering av humane celler og vev og for å innrette aktiviteten i henhold til vilkårene som følger av godkjenningen. Forskriften har egne bestemmelser som stiller krav til ansvarlig person og til personalets kompetanse.
2.3 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Klassifisering av avvik:
- Kritisk avvik (K): Avvik som utgjør en signifikant risiko for skade på donor eller mottaker av blod, celler, vev og/eller organer.
- Stort avvik (S): Ikke kritisk avvik som utgjør en indirekte risiko for sikkerheten til donor og mottaker av blod, celler, vev og og/eller organer ved
- avvik fra gjeldende myndighetskrav for håndtering av blod, celler, vev og/eller organer
- svikt i prosedyrene for frigivelse av blod, celler, vev og/eller organer til bruk på mennesker, eller at ansvarlig person ikke har utført sine legale plikter
- manglende godkjenning fra Helsedirektoratet for aktuell aktivitet
En kombinasjon av flere mindre mangler som hver for seg ikke utgjør et stort avvik, men som til sammen utgjør et stort avvik, skal rapporteres som det.
- Andre avvik (A): Avvik som ikke kan klassifiseres som kritisk eller stort, men som innebærer manglende samsvar med kravene til god praksis som følger av forskriftene for håndtering av blod, celler, vev og/eller organer.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold i Norge som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet, eller aktivitet i andre land.
3. Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 5. januar – 21. april 2021.
Tilsynet ble gjennomført på følgende måte:
- Varsel om tilsyn ble sendt 5. januar 2021.
Varselbrevet inkluderte et egenrapportskjema for aktiviteter som omfattes av forskriften. Konsulenten ble bedt om å fylle ut og returnere skjemaet til Helsetilsynet sammen med etterspurte dokumenter.
I varselbrevet informerte Helsetilsynet om at det ville bli gjennomført et møte med konsulenten 18. februar 2021 i Helsetilsynets lokaler. Det ble videre informert om at dersom smittesituasjonen i Norge i forbindelse med koronapandemien tilsa at fysisk møte ikke burde gjennomføres, kunne det bli aktuelt å gjennomføre møtet digitalt.
- Innhentede dokumenter ble gjennomgått og vurdert.
Oversikt over dokumenter Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i vedlegg 1.
- Møte med konsulenten ble gjennomført 18. februar 2021.
På grunn av smittesituasjonen ble møtet gjennomført digitalt. Agenda for videomøtet var følgende:- Velkommen - presentasjonsrunde
- Innledning ved Helsetilsynet
- Håndtering av navlestrengsblod og navlestrengsvev i Norge
- Veien videre
I tillegg til konsulenten deltok revisjonslaget på møtet.
- Foreløpig rapport ble sendt virksomheten 22. mars 2021.
Virksomheten ble bedt om å gi en tilbakemelding til Helsetilsynet på at konsulenten hadde gjennomgått foreløpig rapport og eventuelt om rapporten inneholdt faktiske feil.
- Helsetilsynet mottok tilbakemelding på foreløpig rapport fra virksomheten 16. april 2021.
Virksomheten hadde ikke funnet faktiske feil i rapporten. I tilbakemeldingen gir virksomheten også kommentarer til «kommende ændringer (avvik), som allerede er i gang med at blive ændret og implementeret».
3.2 Revisjonslag
- Seniorrådgiver/bioingeniør Elisabeth Try Valø (revisjonsleder)
- Seniorrådgiver/jordmor Tonje Vråle (revisor)
- Fagsjef/bioingeniør Tone Blørstad (revisor)
4. Relevante forhold ved virksomheten
I sin rolle som konsulent for Save Stem Cell Center er Janne Marsteen definert som en egen virksomhet og godkjent av Helsedirektoratet for «donasjon, uttak, koding og merking og distribusjon av navlestrengsblod og –vev» i Norge. Virksomheten består kun av konsulenten som også er ansvarlig person etter forskriften for aktiviteten i Norge.
Konsulenten har inngått en stedfortrederavtale med Save Stem Cell Center i Danmark for høsting av navlestrengsblod og navlestrengsvev i Norge.
4.1 Save Stem Cell Center
Save Stem Cell Senter (SSCC) er en privat stamcellebank i Danmark som tilbyr oppsamling og oppbevaring av stamceller fra navlestrengen til nyfødte barn i Norge og Danmark. SSCC ble startet i oktober 2018, da de overtok aktiviteten etter Vita 34 Aps som valgte å opphøre som direkte aktør på det nordiske markedet.
SSCC retter sine tilbud mot mødre/par privat. Høsting av navlestrengsblod og navlestrengsvev for eventuell senere autolog bruk er ikke en del av den offentlige helsetjenesten i Norge. Bestilling foregår ved at kommende foreldre (kunden) kjøper en fødselspakke fra SSCC i Danmark. Fødselspakken inneholder utstyr til å høste navlestrengsblod, og eventuelt navlestrengsvev, i forbindelse med fødselen. SSCC har inngått en samarbeidsavtale med én konsulent som skal gjennomføre selve høstingen i Norge.
Etter høsting blir det oppsamlede materialet transportert til Tyskland. SSCC har inngått en samarbeidsavtale med Vita 34 AG hvor de oppsamlede stamcellene fra navlestrengsblodet og navlestrengsvevet bearbeides og testes før de fryses ned. Når stamcellene er frosset ned, kan kunden inngå en avtale om 20, 25 eller 50 års lagringstid. Stamcellene oppbevares i stamcellebanken til Vita 34 AG i Leipzig.
Etter 3-4 måneder vil kunden motta alle testresultatene og et sertifikat på stamcellene som oppbevares. SSCC bistår dersom det senere er behov for å utlevere stamcellene for medisinsk behandling av barnet.
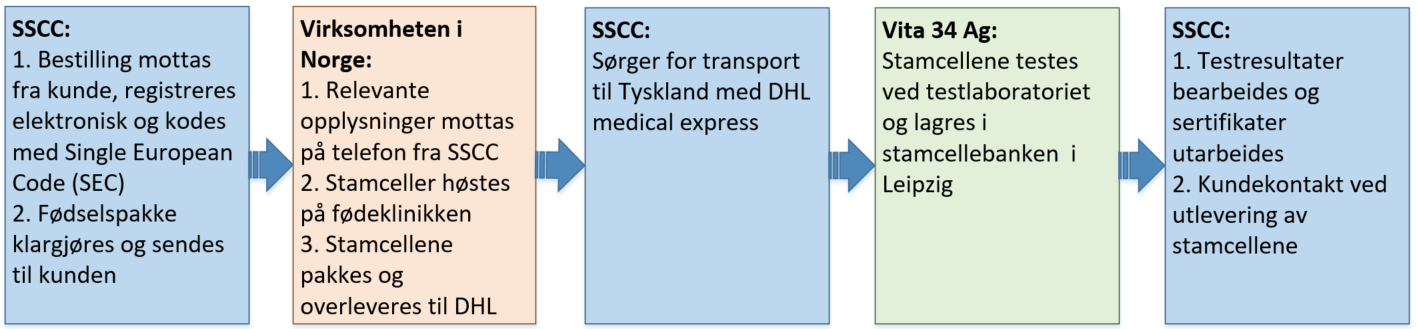
Figur 1 Bestilling, høsting, håndtering og oppbevaring av navlestrengsblod og –vev
4.2 Aktivitet i Norge
Aktiviteten i Norge er organisert som en egen virksomhet. Virksomheten har hatt godkjenning fra Helsedirektoratet etter forskrift om håndtering av humane celler og vev siden 3. desember 2019. Konsulenten er virksomhetens ansvarlige person. Ansvarlig person har ansvar for at virksomheten etterlever kravene i forskriften og vilkårene som er lagt til grunn for Helsedirektoratets godkjenning.
Ut fra opplysninger gitt til Helsetilsynet er det etter oppstart av virksomheten i 2019 høstet navlestrengsblod 26 ganger og navlestrengsvev 23 ganger i Norge. Høstingen har foregått ved seks ulike helseforetak.
5. Faktiske forhold, vurderinger og konklusjon
Dette tilsynet omfatter kun aktiviteten i Norge.
5.1 Oppsummering
Helsetilsynet avdekket ett avvik innen de reviderte områdene.
5.2 Håndtering av navlestrengsblod og navlestrengsvev
5.2.1 Høsting av navlestrengsblod og navlestrengsvev
Helsetilsynet har fått opplyst at kunden varsler vakthavende jordmor hos SSCC i Danmark når fødselen er i gang. Deretter gjennomføres høsting av navlestrengsblod og navlestrengsvev på følgende måte:
- Konsulenten får en telefon fra vakthavende jordmor hos SSCC i Danmark, og relevante opplysninger om kunden og fødested blir oppgitt. Konsulenten kan selv velge å si ja eller nei til oppdraget.
- Konsulenten reiser til sykehuset og henvender seg på vaktrommet ved ankomst.
- Kunden har vanligvis med seg fødepakken som skal benyttes ved høsting.
- Rett før eller rett etter fødselen dekker konsulenten opp med sterilt utstyr på et eget bord eller i fødesenga, eventuelt på et annet rom. Dersom fødselen foregår ved keisersnitt, blir det dekket opp på et annet rom og morkaken med navlestrengen blir brakt til konsulenten.
- Merkelapp som følger med fødepakken blir satt på blodposen i oppsamlingssettet. Konsulenten kontrollerer at informasjonen på merkelappen samsvarer med merking på utsiden av fødepakken.
- Avnavling av barnet blir vanligvis utført 1-3 minutter etter fødsel, mens høstingen av navlestrengsblodet helst skal påbegynnes senest 1-3 minutter etter fødsel. Konsulenten tilstreber å koordinere tidspunkt for avnavling med jordmor slik at høstingen blir mest mulig optimal.
- Navlestrengsblodet blir høstet ved å sette en nål koplet til en slange med blodpose (oppsamlingssettet) inn i navlestrengen som vist i figur 2. Blodet blir overført til blodposen ved hjelp av tyngdekraften. Om nødvendig kan navlestrengen melkes lett.
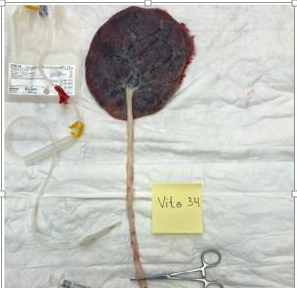
Figur 2 Illustrasjon hentet fra prosedyre som beskriver oppsamling av «navlesnorsblod og navlesnor i forbindelse med fødsler i Danmark og Norge»
- Posen veies før og etter høsting.
- Dersom navlestrengsvev også skal høstes, klippes selve navlestrengen av og legges i en boks som følger med fødepakken.
- Høstet materiale blir pakket og overlevert DHL på Skedsmokorset i Lillestrøm. Dersom stamcellene blir høstet på kveld, natt eller helg, tar konsulenten med seg materialet hjem for overlevering til DHL senere. Transporten med DHL til Vita 34 Ag i Tyskland blir bestilt av SSCC i Danmark. Stamcellene skal oppbevares i romtemperatur fra de er høstet til de når laboratoriet i Tyskland.
Konsulenten har oppgitt at hun har høstet navlestrengsblod og navlestrengsvev i forbindelse med åtte fødsler ved tre ulike helseforetak etter at virksomheten fikk godkjenning fra Helsedirektoratet i desember 2019. Ved én fødsel ble høsting utført av annet helsepersonell og deretter overlevert fra far til konsulenten utenfor sykehuset. Konsulenten overleverte pakken med det humane materialet til DHL for transport til Tyskland. De resterende høstingene er blitt utført av annet helsepersonell uten at konsulenten har vært involvert.
5.2.2 Ledelse og kvalitetsforbedring
Konsulenten har inngått en stedfortrederavtale med SSCC for høsting av navlestrengsblod og navlestrengsvev i Norge. Avtalen ble inngått 01.11.2018 og var gyldig til 31.10.2019. Helsetilsynet har fått opplyst at avtalen ikke er fornyet.
SSCC har utarbeidet en prosedyre som beskriver «hvorledes Save’s personale opsamler navlesnorsblod og navlesnor i forbindelse med fødsler i Danmark og Norge». I tillegg har SSCC utarbeidet en prosedyre som beskriver hvordan avvik skal meldes og håndteres. Begge prosedyrene gjelder for virksomheten i Norge. Konsulenten var tidligere ansatt i en annen godkjent virksomhet for håndtering av navlestrengsblod og fikk sin opplæring i de aktuelle oppgavene i dette ansettelsesforholdet.
Virksomheten har, etter avtale med SSCC, godkjenning fra Helsedirektoratet etter forskrift om håndtering av humane celler og vev, og konsulenten er ansvarlig person for aktiviteten i Norge. I vedtaksbrevet for godkjenning av denne aktiviteten står det at godkjenningen gjelder for høsting av navlestrengsblod og navlestrengsvev på offentlige fødeavdelinger i Norge. Konsulenten har «ansvaret for å innrapportere uønskede hendelser/bivirkninger, samt å trene opp personell som gjør uttak av navlestrengsblod. Dette skal være norskautorisert helsepersonell, kontraktert direkte med Save Stem Cell Center. Opplæringen omfatter oppsamling av celler og vev, merking av transportkasse, sporbarhet og dokumentasjon. Opplæringen av lokalt helsepersonell dokumenteres». Videre vilkår for godkjenningen er blant annet at virksomheten skal
- sørge for at donerte celler og vev merkes med en unik kode som tilfredsstiller kravene til felles europeisk kode (SEC). Navlestrengsblod og navlestrengsvev som er donert i Norge skal ha norsk SEC-kode som inkluderer norsk landkode og norsk virksomhetskode.
- sørge for at alt «helsepersonell som utfører aktiviteter på vegne av virksomheten i Norge har gyldige tredjepartsavtaler»
- sikre at «nødvendige testresultater fra mor foreligger før tapping (jf. § 17), og at cellene og vevet behandles og merkes i henhold til eventuell infeksjonssykdom (jf. § 38 f)».
- ivareta kravene til «etablering og registrering av sporbarhetsopplysninger i et donasjonsregister (jf. kap. 9)»
Under tilsynet har Helsetilsynet ved gjennomgang av innhentet dokumentasjon og intervju med konsulenten mottatt følgende informasjon:
- Prosedyren utarbeidet av SSCC som omhandler høsting av navlestrengsblod og navlestrengsvev beskriver blant annet retningslinjer ved hjemmefødsler. Godkjenningen til virksomheten omfatter ikke høsting i forbindelse med hjemmefødsler.
- Prosedyren utarbeidet av SSCC som omhandler avvikshåndtering, beskriver ikke hvordan uønskede hendelser og bivirkninger skal rapporteres til det norske meldesystemet. Konsulenten var ikke orientert om dette meldesystemet.
- Navlestrengsblod og navlestrengsvev som er donert i Norge merkes med en SEC-kode som er generert av SSCC. Det var ikke kjent for konsulenten om genererte koder er danske, tyske eller norske.
- Konsulenten hadde ikke informasjon om helsepersonell som har høstet navlestrengsblod og navlestrengsvev for SSCC i Norge hadde inngått tredjepartsavtale direkte med SSCC. Konsulenten hadde ikke inngått noen tredjepartavtaler med helsepersonell.
- Konsulenten har gjennomført opplæring av annet helsepersonell i sitt tidligere ansettelsesforhold. Slik opplæring er ikke gjennomført for annet personell som høster navlestrengsblod og navlestrengsvev for SSCC i Norge.
- Vilkårene om at det skal foreligge «nødvendige testresultater fra mor før tapping» jf. forskriftens § 17, og at høstet materiale skal behandles og merkes i forhold til eventuell infeksjonssykdom, er ikke oppfylt.
- Konsulenten registrerer opplysninger på en nettside til SSCC etter høsting, men er ikke kjent med om dette registeret tilfredsstiller kravene til et donasjonsregister som følger av forskriften.
5.3 Avvik
Avvik 1:
Virksomheter som håndterer navlestrengsblod og navlestrengsvev beregnet for oppbevaring og senere autolog bruk skal blant annet sikre sporbarhet for oppsamlet materiale og redusere risikoen for overføring av sykdom via celler og vev. Helsetilsynet vurderer at den aktuelle virksomheten i Norge ikke etterlever kravene som er satt til sporbarhet og til smittetesting av mor før høsting av navlestrengsblod og navlestrengsvev. Videre foreligger det brudd på kravene til avtaler med, og opplæring av, annet involvert helsepersonell (S).
Avvik fra følgende krav i forskrift om håndtering av humane celler og vev:
§ 6 Ansvarlig person
§ 7 Krav til personalets kompetanse
§ 9 Avtaler med tredjepart
§ 17 Obligatoriske laboratorieundersøkelser for donorer
§ 41 Felles europeisk kode (SEC)
§ 45 Etablering av donasjonsregister og formål
§ 53 Melding om alvorlige uønskede hendelser
§ 54 Melding om alvorlige bivirkninger
6. Oppfølging av påpekte avvik
Helsetilsynet har merket seg at virksomheten etter gjennomgang av foreløpig rapport har foreslått og kommentert mulige forbedringstiltak etter tilsynet.
Helsetilsynet ber om at følgende dokumentasjon sendes oss innen 10. juni 2021:
- virksomhetens handlingsplan for korrigerende tiltak, inkludert hva som er implementert og eventuelle frister for implementering av det som ikke er ferdigstilt
- beskrivelse av hvordan virksomheten skal sikre at smittettester av mor utføres ved et laboratorium som er godkjent av Helsedirektoratet for dette formålet, jf. forskrift om håndtering av humane celler og vev, § 17
- beskrivelse av virksomhetens donasjonsregister, jf. forskrift om håndtering av humane celler og vev, § 45
- beskrivelse av hvordan virksomheten skal følge opp at iverksatte tiltak fungerer etter hensikten
Dokumentasjonen sendes som e-post til postmottak@helsetilsynet.no med kopi til etv@helsetilsynet.no
Med hilsen
Anders Haugland etter fullmakt
fung. avdelingsdirektør
Elisabeth Try Valø
seniorrådgiver
Brevet er godkjent elektronisk og sendes derfor uten underskrift
Saksbehandler: Elisabeth Try Valø, tlf. 21 52 99 83
Vedlegg: 1 Dokumentunderlag
Kopi til:
Helsedirektoratet
Statens legemiddelverk
Statsforvalteren i Oslo og Viken
Save Stem Cell Center i Danmark