Rapport etter tilsyn Akershus universitetssykehus HF - håndtering av blod, blodkomponenter, celler og vev 2023
Oppfølging av tilsynet
I dette tilsynet ble det ikke avdekket lovbrudd. Tilsynet er derfor avsluttet.
Statens helsetilsyn har i perioden 9. januar – 23. mai 2023 gjennomført tilsyn med Akershus universitetssykehus HF. Tilsynet omfattet håndtering av blod, blodkomponenter, celler og vev og ble utført i henhold til følgende forskrifter:
- Forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev
Hensikten med tilsynet var å undersøke om ledelsen ved Akershus universitetssykehus HF sikrer et høyt beskyttelsesnivå for givere/donorer og mottakere, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Tilsynet ble gjennomført ved innhenting og gjennomgang av informasjon og dokumentasjon. I tillegg ble det gjennomført tilsynsbesøk med stikkprøver og intervjuer med involvert personell og deres ledere. Tilsynsbesøket fant sted 6. – 10. mars 2023.
Det ble ikke avdekket avvik innen de reviderte områdene. Tilsynet betraktes derfor som avsluttet.
1 Tilsynets tema og omfang
Statens helsetilsyn fører jevnlige tilsyn med håndtering av blod, blodkomponenter, celler og vev. Tilsynet gjennomføres etter helsetilsynsloven § 4, blodforskriften § 5-1 annet ledd og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Hensikten med tilsynet var å undersøke om ledelsen ved Akershus universitetssykehus HF (Ahus) sikrer et høyt beskyttelsesnivå for mottakere og givere/donorer, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Vi har i dette tilsynet lagt hovedvekt på følgende:
- Håndtering av blod og blodkomponenter for transfusjon:
- bestilling, pretransfusjonsundersøkelser herunder utstyr/reagenser, valg og utlevering av blod og blodkomponenter
- sporbarhet - mulighet til å identifisere blod og blodkomponenter fra giver til mottaker og omvendt
- Håndtering av humane celler og vev, inkludert testing av donorer av celler og vev:
-
- samsvar mellom helseforetakets praksis og godkjenning(er) etter forskrift om håndtering av humane celler og vev
- donasjon, uttak, oppbevaring, anskaffelse og merking av humant bein, brusk og senevev
- testing av donorer av humane celler og vev
2 Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer blod, blodkomponenter, celler og vev etterlever gjeldende lov- og forskriftsbestemmelser.
Lovgrunnlag for tilsynet:
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
- forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
Blodforskriften og forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
Transfusjon av blod og blodkomponenter krever samhandling mellom involvert personell ved blodbanker og/eller transfusjonsenheter og kliniske avdelinger. Kravene til sporbarhet og dokumentasjon av gjennomførte transfusjoner i pasientjournal er utdypet i blodforskriften.
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i aktuell forskrift.
2.2 Nærmere om forsvarlighet
Det er et grunnleggende krav til helsetjenesten at den helsehjelpen som ytes er faglig forsvarlig.
Kravet om forsvarlighet er en rettslig standard. Dette innebærer at innholdet bestemmes med utgangspunkt i normer utenfor loven. Disse normene er forankret i anerkjent fagkunnskap, faglige retningslinjer og samfunnsetiske normer, og utgjør det som betegnes som god praksis. Samtidig danner normene utgangspunkt for å fastlegge hvor grensen mot det uforsvarlige går.
Kravet om forsvarlighet er også et krav om forsvarlig organisering av tjenesten. I dette ligger blant annet at det gjennomføres organisatoriske og systemmessige tiltak som gjør det mulig for helsepersonellet å oppfylle plikten til forsvarlig yrkesutøvelse. Det følger av dette at virksomheten må styre sin drift med siktemål om at tjenestene er i samsvar med god praksis.
Det er en nær sammenheng mellom kravet til forsvarlighet, kravet til internkontroll og systematisk arbeid for å ivareta pasientenes sikkerhet, jf. helsetilsynsloven § 3 og forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
2.3 Nærmere om krav til et kompetent laboratorium
Forskrift om håndtering av humane celler og vev § 18 stiller krav om at smittetesting av donorer av celler og vev skal utføres av et kompetent laboratorium. Helsetilsynet har lagt Europarådguiden[1] og standarden ISO 15189 til grunn ved utdyping av kravene som stilles til et kompetent laboratorium.
Punktene under gir et sammendrag av kravene som er mest relevante for dette tilsynet, og som ikke er utdypet i lov og forskrift. Ledelsen ved laboratoriet skal blant annet sikre at
- utstyr som benyttes er verifisert ved installasjon og før bruk
- reagenser oppbevares etter leverandørenes instruksjoner
- alle mottatte prøver skal registreres og godkjent personale skal evaluere mottatte prøver
- analysen er validert for type prøvemateriale som skal testes
- utstyr som direkte eller indirekte påvirker analyseresultatene er kalibrert
- kvalitetskontroller analyseres rutinemessig, og nødvendige tiltak iverksettes om resultatene er utenfor godkjenningskriteriene
- laboratoriet deltar i program for sammenlignende laboratorieundersøkelser, overvåker resultatene av programmet og eventuelt iverksetter korrigerende tiltak
- identiteten til personer som utfører aktivitetene i analyseprosesser blir registrert
- laboratorieresultatene rapporteres nøyaktig, klart og utvetydig
- laboratoriet planlegger og gjennomfører interne revisjoner med fastsatte intervaller
For fullstendig tekst viser vi til Europarådguiden for celler og vev kapittel 5 og ISO 15189.
2.4 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet.
3 Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 9. januar – 23. mai 2023.
For beskrivelse av hvordan tilsynet ble gjennomført og program for tilsynsbesøket se vedlegg 1 og 3.
3.2 Deltakere
Deltakere fra Ahus:
- kontaktperson fra virksomheten: seniorrådgiver Maj-Britt Aarnes Hvammen
- for oversikt over andre deltakere viser vi til vedlegg 4.
Deltakere fra Helsetilsynet:
- seniorrådgiver Tone Andersen (revisjonsleder)
- seniorrådgiver Kristine Bjerkaas-Kjeldal (revisor)
4 Innledende informasjon om virksomheten
Ahus HF eies av Helse Sør-Øst RHF. Hovedoppgavene er pasientbehandling, forskning, undervisning og pasientopplæring. Ahus har også pasienttilbud innen somatikk, psykisk helsevern og rusbehandling. Virksomheten foregår på Nordbyhagen i Lørenskog, Nordre Follo, Kongsvinger, Gardermoen og ved ulike behandlingsteder for psykisk helsevern og rusbehandling.
Ahus er organisert med administrerende direktør som helseforetakets øverste leder. Helseforetaket er organisert i divisjoner og klinikker med felles fag- og stabsenheter. Divisjonene og klinikkene er videre organisert i avdelinger og seksjoner.
Helseforetaket har blodbankvirksomhet på Nordbyhagen og Kongsvinger samt tappestasjoner på Lillestrøm, Gardermoen og Ski. På Nordbyhagen er blodbanken en del av immunologisk og transfusjonsmedisinsk avdeling mens på Kongsvinger er blodbanken organisert under Tverrfaglig Laboratoriemedisin og Medisinsk Biokjemi (TLMB). Begge avdelinger ligger under divisjon diagnostikk og teknologi (DDT). Blodbanken forsyner de kliniske avdelingene med blod og blodkomponenter til transfusjon. Transfusjon foregår ved kliniske avdelinger ved sykehusene på Nordbyhagen og i Kongsvinger.
|
Sykehus |
Erytrocyttkonsentrat |
Octaplas |
Trombocytter |
|
Ahus |
11994 |
3806 |
1702 |
*Tallene er hentet fra Transfusjonsstatestikk for 2021
Ahus har godkjenning fra Helsedirektoratet for smittetesting av donorer av celler og vev. Smittetestingen foregår ved TLMB og det medisinskfaglige ansvaret er lagt til avdeling for mikrobiologi og smittevern (MIKS). De to avdelingene er organisert under divisjon for diagnostikk og teknologi.
Videre har Ahus godkjenning fra Helsedirektoratet for «Donasjon, uttak, oppbevaring, anskaffelse og merking av humant bein, brusk- og senevev til allogen transplantasjon samt uttak av autologe celler og blod til celledyrking». Aktiviteten er lagt til benbanken, ortopedisk klinikk.
Helseforetaket har i egenrapportskjema oppgitt til Helsetilsynet at de ikke håndterer andre typer celler og vev som krever godkjenning fra Helsedirektoratet enn de vi omtaler her.
5 Beskrivelse av faktagrunnlag, vurdering og konklusjon
5.1 Oppsummering
Helsetilsynet har ikke funnet grunnlag for å konkludere med avvik innen de reviderte områdene.
I dette kapittelet beskriver vi de faktiske forholdene vår vurdering og konklusjon bygger på. Beskrivelsen omfatter helseforetakets håndtering av blod, blodkomponenter, celler og vev, inkludert smittetesting av donorer av celler og vev, og er avgrenset til forhold som ble avdekket under tilsynet.
5.2 Håndtering av blod og blodkomponenter ved Ahus
5.2.1 Helseforetakets egenkontroll
Som en del av tilsynet har blodbankene på Nordbyhagen og i Kongsvinger gjennomført en egenkontroll i form av stikkprøver jf. punkt 3.1. Stikkprøvene omfattet kontroll av dokumentasjon for et utvalg utførte oppgaver ved blodbestilling, pretransfusjonsundersøkelser, herunder utstyr/reagenser, samt valg og utlevering av blod og blodkomponenter. Helsetilsynet hadde forhåndsdefinert enkelte av de utvalgte oppgavene i forbindelse med blodbestilling og pretransfusjonsundersøkelser som særlig kritiske for pasientsikkerheten, og markert dem i egenkontrollskjemaet.
Under tilsynsbesøket ble de ansatte intervjuet om praksis for disse oppgavene.
Helseforetakets egenkontroll avdekket ingen avvik.
5.2.2 Identitetssikring ved blodprøvetaking til pretransfusjonsundersøkelser
Under tilsynsbesøket ble Helsetilsynet fortalt at Ahus har desentralisert blodprøvetaking. Alle blodprøver, inkludert pretransfusjonsprøver blir tatt av sykepleiere på de ulike kliniske avdelingene. Vi ble fortalt følgende vedrørende identitetskontroll av pasient ved blodprøvetaking til pretransfusjonstesting:
- Prøvetaker spør om fullt navn og personnummer og id-bånd blir sjekket.
- Hvis pasienten ikke kan gjøre rede for seg skal identitetsopplysningene på DIPS-etikett (etikett skrevet ut fra elektronisk pasientjournal) sjekkes opp mot opplysningene på id-bånd eller gyldig legitimasjon.
- Pasienten kan også identifiseres ved at opplysningene på DIPS-etiketten bekreftes av en person som kjenner pasienten. Denne kontrollen utføres i henhold til prosedyren «Ahus- Pretransfusjonsprøver (ABO-typing og screening)».
Involvert personell fortalte videre at ID-kontroll bekreftes ved at prøvetaker signerer etiketten på prøveglasset samt skriver dato og klokkeslett. Blodprøveglass til pretransfusjonsundersøkelser uten signatur avvises.
Sentrale regler
- Spesialisthelsetjenesteloven § 2-2 forsvarlighetskrav jf. bl.a. klinisk transfusjonhåndbok pkt. 3-2.
5.2.3 Blodbestilling og utlevering av blodprodukter
5.2.3.1 Nordbyhagen
De kliniske avdelingene bestiller blod og blodprodukter elektronisk og ved hastesituasjoner via telefon. Oversikt over bestillingene kommer opp på PC-skjem ved utleveringsplassen på blodbanken samt inne på vaktrommet. Ny bestilling varsles med lydsignal.
Blod og plasma klargjort til pasienter sendes via rørpost ut til avdelingene. Før forsendelse i rørposten registrerer blodbanken dato, tappenummer, klokkeslett, rørpostnummer/adresse, nummer på rørpostpatronen samt signatur i skjemaet «Poser sendt i rørpost».
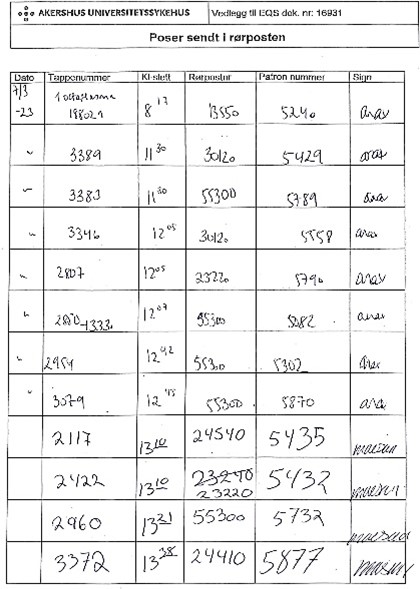 Figur 1: Utfyllingsskjema: «Poser sendt i rørpost.»
Figur 1: Utfyllingsskjema: «Poser sendt i rørpost.»
Trombocyttkonsentrat må hentes på blodbanken og utleveres da av blodbankpersonalet. Det er adgangskontroll til blodbankens lokaler. Utvalgte avdelinger er gitt tilgang til blodbankens lokaler og kan hente kriseblod som står i utleveringsskap på blodbanken.
5.2.3.2 Kongsvinger
Avdelingene bestiller blod og blodprodukter elektronisk på dagtid på ukedager. Ved hastesituasjoner og på vakt (kveld, natt, helg) mottar blodbanken bestillingen via telefon. Blod klargjort til pasienter legges i utleveringsskap som står inne på blodbanken. Også blodbanken i Kongsvinger har adgangskontroll, og personale fra avdelingene med tilgang til blodbanken henter selv blodet og signerer på utleveringsrapport i perm ved siden av utleveringsskapet. Blodbankpersonale leverer ut plasma og trombocyttkonsentrat.
Sentrale regler
- Blodforskriften § 3-12 Produktets integritet og kvalitet skal bevares ved utlevering
- Blodforskriften, vedlegg VI punkt 7 Oppbevaring og distribusjon
5.2.4 Kontroll av reagenser og medisinsk utstyr
Under tilsynsbesøket ble Helsetilsynet fortalt og vist følgende:
- Fagbioingeniør gjør mottakskontroll av celler, kassetter og reagenser fra leverandør. Helsetilsynet fikk se dokumentasjon på dette. Kontrollerte kassetter og celler blir merket og/eller satt på plasser merket «klar til bruk».

Figur 2: Fra blodbanken Nordbyhagen: Bildet viser eske med reagens som er merket «Kontrollert, ferdig til bruk».

Figur 3: Fra blodbanken Kongsvinger: Bildet viser oppbevaringsplasser som er merket med «Celler og reagenser klar til bruk».
- Cellepaneler blir kontrollert ved mottak og ved utløpsdato.
- Celler, kassetter og reagenser blir oppbevart ved anbefalt temperatur, og temperaturkritiske områder har elektronisk overvåking koblet til lyd- og lysalarm (Nordbyhagen) og til vakttelefon (Kongsvinger). Helsetilsynet ble vist at ansatte må kvittere ut kontrollert alarm i liste ved siden av PC med installert elektronisk overvåkingsprogram.
- Daglig, ukentlig og månedlig vedlikehold på medisinsk utstyr blir utført etter plan. Helsetilsynet fikk se dokumentasjon på dette.
- Periodisk vedlikehold (PV) utføres av leverandør og servicerapport lagres elektronisk på seksjonen medisinsk teknikk (MT). Helsetilsynet fikk se at på Kongsvinger blir rapporten også lagret elektronisk på blodbanken samt som papirutgave i perm.
- Etter utført PV og service fra leverandør blir det kjørt kontroller før medisinsk utstyr blir tatt i bruk.
Sentrale regler
- Blodforskriften
- 3-10 jf. vedlegg VI – punkt 4 Utstyr og materialer
Alt utstyr skal valideres, kalibreres og vedlikeholdes så det egner seg til tiltenkt formål.
5.2.5 Kvalitetssikring av de utførte analysene
Under tilsynsbesøket fikk Helsetilsynet opplyst at analyser som utføres ved blodbankene på Ahus blir kvalitetssikret ved bruk av interne og eksterne kvalitetskontroller.
Interne kvalitetskontroller blir satt opp daglig og ved behov. Resultatene fra kvalitetskontrollene blir fulgt opp, og Helsetilsynet fikk se dokumentasjon på utførte kvalitetskontroller. På Ahus, Nordbyhagen må analyser utført på analyseinstrumentet uten «gyldige» kontroller, sjekkes og godkjennes manuelt før resultatene overføres til blodbankdatasystemet (LabCraft). Det vil ligge en merknad om dette på prøvesvaret i analyseinstrumentets loggføring.
Blodbankene på Ahus deltar i de eksterne kvalitetsprogrammene, «Nasjonale kvalitetskontroller av immunhematologiske analyser» og Equalis.
Helsetilsynet ble fortalt følgende om rutinen ved deltakelse i eksterne kvalitetsprogram:
- På Ahus, Nordbyhagen utføres og besvares kontrollene som en del av den vanlige rutinedriften av den /de personene som er på de aktuelle arbeidsstasjonene de aktuelle dagene. Ved blodbanken på Kongsvinger er det hovedsakelig fagbioingeniør som utfører de eksterne kvalitetskontrollene.
- Tilbakemeldingsrapporten fra de eksterne kvalitetskontrollene gås igjennom av fagbioingeniør og signeres av seksjonsleder og medisinsk ansvarlig lege og lagres elektronisk. Eventuelle avvik meldes i EQS.
- Blodbanken på Ahus, Nordbyhagen har årlig foredrag om resultatene fra de eksterne kontrollene for de ansatte på blodbanken.

Figur 4: Skjemaer som viser hvilke metoder eksterne kvalitetskontroller skal utføres med. Bildene er kun illustrasjoner som brukes som eksempler og informasjonen på de er ikke viktig.
Sentrale regler
- Blodforskriften
- § 3-10 jf. vedlegg VI punkt 6.3 Laboratorieundersøkelser.
Kvaliteten til laboratorieundersøkelsene skal vurderes regelmessig ved for eksempel deltakelse i et eksternt kvalitetssikringsprogram.
5.2.6 Ledelse og kvalitetsforbedring
Under tilsynsbesøket ble Helsetilsynet fortalt og vist følgende:
- Blodbankene på Ahus bruker læringsportalen ved dokumentasjon av opplæring og vedlikehold av kompetanse.
- Ahus har utarbeidet sjekklister som brukes ved opplæring, én for hvert arbeidsområde/funksjon. Fagbioingeniør og seksjonsleder godkjenner opplæringen.
- Utarbeidede prosedyrer ligger i elektronisk kvalitetssystem, Extended Quality System (EQS) og har en gyldighet på 2 år. Endringer i prosedyrene tas opp i seksjonsmøter.
- Blodbankene har definert enkelte prosedyrer som hovedprosedyrer. For disse prosedyrene har de valgt funksjonen implementeringsstøtte i EQS. Ansatte må signere for «lest og forstått» i hovedprosedyrene og mottar varsel på e-post ved endringer i prosedyrene.
- Validering av nytt utstyr blir utført i henhold til prosedyren «Endringskontroll og bruk av fleksibel akkreditering». Helsetilsynet har mottatt godkjente valideringsrapporter som ble utarbeidet ved anskaffelse av nye plasmatinere på blodbankene i 2022.
- Avvik meldes og håndteres, og relevante avvik blir tatt opp på de ukentlige seksjonsmøtene.
- Internrevisjonplan for DDT for 2023 er utarbeidet. Helsetilsynet har mottatt revisjonsplanen samt blitt vist revisjonsrapporten fra siste revisjon i juni 2022 som omhandlet aferese utført på Nordbyhagen og Ski.
- Ledelsens gjennomgang (LG) blir utført årlig. Rapport fra LG ligger tilgjengelig for alle.
Blodbanken på Kongsvinger benytter sjelden manuelle metoder til blodtypebestemmelse og screening av blodtypenatistoffer. Helsetilsynet merket seg at blodbanken gjennomfører jevnlig kurs i manuelle metoder for å ivareta denne kompetansen.
Sentrale regler
- Blodforskriften
- § 2-3 stiller krav om at oppgaver kun utføres av personale som har fått tilstrekkelig opplæring og er kvalifisert til det, jf. vedlegg VI.
- § 2-4 fastsetter at blodbanker og transfusjonsenheter skal etablere internkontroll for å sikre at virksomheten planlegges, organiseres, utføres og vedlikeholdes i samsvar med regler fastsatt i lov og forskrift. Internkontrollen skal tilpasses virksomhetens art, aktiviteter, størrelse og risikoforhold i det omfang som er nødvendig for å etterleve kravene, samt de standarder og spesifikasjoner til et kvalitetsstyringssystem som følger av vedlegg VI. Internkontrollen skal dokumenteres.
5.3 Smittetesting av donorer av celler og vev ved Ahus
5.3.1 Rekvirering, mottak og laboratorieundersøkelser av donorprøver
Ahus har elektronisk system for rekvirering av laboratorieundersøkelser. Rekvirentene bestiller vanligvis donorprøver elektronisk. Blodprøver til donortestingen mottas i prøvemottak ved TLMB. I enkelte tilfeller kommer rekvisisjon på papir, og denne scannes i prøvemottak. Ahus har opprettet egne analysekoder for registrering av donorprøver, BEND (bendonor), IVFM (IVF mann), IVFM (IVF kvinne). Kodene velges av rekvirent og hver kode inkluderer alle obligatoriske smittetester for donorer av celler og vev i henhold til krav i forskrift om håndtering av celler og vev § 17.
Helsetilsynet ble vist og fortalt følgende vedrørende mottak av donorprøver:
- Donorprøven går på transportbånd i et automatisk prøvefordelingssystem. Her kontrolleres prøveinnholdet før donorprøven sendes til riktig analysemaskin.
- Donorprøven og andre pasientprøver behandles og analyseres på samme måte.
- Prøver med usikre analysesvar følger egen valideringsprosedyre og blir kontrollert enten ved at Ahus selv utfører en konfirmasjonstest, eller at prøven blir sendt til et eksternt laboratorium. Melding om dette sendes rekvirent.
Sentralt regelverk
- Forskrift om håndtering av humane celler og vev
- § 17 stiller minstekrav til laboratorieundersøkelser for donorer
- § 18 stiller krav som skal være oppfylt ved laboratorieundersøkelser, og presiserer blant annet at laboratorieundersøkelser skal utføres av et kompetent laboratorium. Helsetilsynet utdyper relevante krav til et kompetent laboratorium i denne rapportens kap. 2.2, inkludert mottak og analysering av donorprøver.
5.3.2 Utstyr og reagenser
Helsetilsynet ble vist at reagenser oppbevares i temperaturovervåket kjøleskap og kjølerom i henhold til anbefaling fra leverandør. Når alarm utløses går det beskjed til vakttelefon og alarmen må kvitteres ut i det elektroniske temperaturovervåkingssystemet.
Vedlikehold av laboratorieutstyr som brukes til donortesting blir utført i henhold til oppsatte planer og dokumenteres. Helsetilsynet ble forevist dokumentasjon på gjennomført vedlikehold. Periodisk vedlikehold utføres av leverandør og servicerapport lagres elektronisk.
TLMB kvalitetssikrer analysene som inngår i smittettesting av donorer av celler og vev ved interne og eksterne kvalitetskontroller. Helsetilsynet fikk se dokumentasjon på gjennomførte interne kvalitetskontroller og rapport fra deltakelse i det eksterne kvalitetskontrollprogrammet UK NEQAS. Rapporten blir gjennomgått av fagbioingeniør og sendes ut med leserbekreftelse til avdelingsleder, seksjonsleder og medisinsk ansvarlig. Eventuelle avvik blir meldt i EQS.

Figur 5: Bildet viser hyller i et kjølerom med merking for plassering av nye reagenslott.
Sentralt regelverk
- Forskrift om håndtering av humane celler og vev
- § 18 stiller krav som skal være oppfylt ved laboratorieundersøkelser, og presiserer blant annet at laboratorieundersøkelser skal utføres av et kompetent laboratorium. Helsetilsynet utdyper relevante krav til et kompetent laboratorium i denne rapportens kap. 2.2, inkludert mottak og analysering av donorprøver.
5.3.3 Rapportering av analyseresultater
Under tilsynsbesøket fikk Helsetilsynet opplyst at rapportering av analyseresultater av donorprøver og andre pasientprøver blir utført på samme måte:
- De aktuelle smittetestene besvares via egen valideringsprosedyre.
- Negative prøvesvar svares ut automatisk.
- Positive prøvesvar vurderes og kommenteres av lege før svar sendes til rekvirent.
Sentralt regelverk
- Forskrift om håndtering av humane celler og vev
- § 18 – krav til kompetent laboratorium.
5.3.4 Ledelse og kvalitetsforbedring
Under tilsynsbesøket ble Helsetilsynet vist og fortalt følgende:
- Opplæring gjennomføres og dokumenteres i læringsportalen. Seksjonsleder godkjenner gjennomført opplæring.
- Det er utarbeidet sjekklister som brukes i opplæring av bioingeniører og leger. I sjekklisten står hvilke prosedyrer som må leses.
- Hver enkelt ansatt har selv ansvar for å holde seg oppdatert.
- Reopplæring må gjennomføres ved fravær lengre enn henholdsvis 8 måneder for bioingeniør og 12 måneder for lege.
- Ansatte får beskjed om endringer i prosedyrene i EQS. Viktige endringer i prosedyrer blir tatt opp på seksjonsmøter.
- Det utføres validering av nye instrumenter og analyser før de blir tatt i bruk. Ahus har utarbeidet prosedyren «Verifisering/Validering av kvantitative analysemetoder». Vi har mottatt verifiseringsrapport som ble utarbeidet etter innføring av analyse for Hepatitt E virus i 2022.
- Avvik meldes og håndteres og tas opp på seksjonsmøter for læring og forbedring. Avdelingsledelsen får jevnlig statistikk over avvikene.
- Revisjonsprogram for DDT for 2023 – 2027 er utarbeidet. Vi ble vist internrevisjonsplan for DDT for 2023 og har mottatt revisjonsrapport fra revisjon utført i september/oktober 2022. Denne revisjonen omfattet bruk av instrumentet Liaison og analysene HbeAs, HbeAg, Varicella Zoster og anti-Hbcore.
- Ledelsens gjennomgang (LG) utføres årlig
- Årsrapport for smittetesting av donorer av celler og vev for 2021 er sendt Helsedirektoratet.
Sentralt regelverk
- Forskrift om håndtering av humane celler og vev
- § 2-3 stiller krav om at oppgaver kun utføres av personale som har fått tilstrekkelig opplæring og er kvalifisert til det, jf. vedlegg VI.
- § 5 Årsrapport og godkjenningsregister: Virksomheten skal hvert å rapportere sine aktiviteter til Helsedirektoratet
- § 7 stiller krav om personell med tilstrekkelig og oppdatert kompetanse.
- § 8 viser til forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten og fastslår at det skal utarbeides standardprosedyrer for alle prosesser som har innvirkning på kvaliteten og sikkerheten ved håndteringen.
- Forskrift om ledelse og kvalitetsforbedring i helsetjenesten
- § 2-3 stiller krav om at oppgaver kun utføres av personale som har fått tilstrekkelig opplæring og er kvalifisert til det, jf. vedlegg VI.
- § 8 og 9 Plikten til å evaluere og korrigere
5.4 Benbankvirksomhet ved Ahus
Helsetilsynet valgte å gjennomføre dokumenttilsyn for dette området med bakgrunn i tidligere tilsynsfunn og innhentet informasjon og dokumentasjon.
Vi har mottatt følgende opplysninger:
- Helseforetaket har ikke gjennomført vesentlige endringer ved benbankvirksomheten etter forrige tilsyn.
- Samtykkeerklæring fra donor og mottaker av benvev blir innhentet.
- Obligatoriske smittetester av donorer av benvev blir utført.
- Høstet benvev oppbevares i dobbel, steril boks i kalibrert og temperaturovervåket fryser.
- Sporbarhet fra donor til mottaker av benvev ivaretas ved manuell registrering i permer.
- Ansvarlig lege går igjennom resultatene av smittetester tatt av pasient og pasientens journalopplysninger. Gjennomgangen er avsluttende kontroll for å vurdere pasientens egnethet som donor, før aktuelt benvev blir frigitt.
- Utarbeidede prosedyrer for benbankvirksomheten er oppdaterte og ligger i EQS.
- Sentraloperasjon dokumenter all opplæring ved benbanken.
- Avvik meldes og håndteres dersom det er aktuelt. Det er ikke meldt avvik for benbankaktiviteten siste to år.
- Internkontroll og gjennomgang av rutiner ved benbanken på Ahus blir gjennomført årlig.
- Årsrapport for benbanken ved ortopedisk klinikk ved Ahus for 2022 er utarbeidet og sendt Helsedirektoratet.
Ut fra foreliggende informasjon og dokumentasjon vurderte Helsetilsynet at det ikke var grunnlag for videre oppfølging av helseforetakets benbankvirksomhet ved dette tilsynet.
Sentrale regler:
- Sentrale krav i forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av celler og vev).
5.5 Helsetilsynet vurdering og konklusjon
Vi redegjør her for våre vurderinger. Faktagrunnlaget med sentrale krav som stilles til blodbankene, TLMB og benbanken er beskrevet i kapitel 5.2, 5.3 og 5.4.
Ahus har etablert rutiner og retningslinjer for håndtering av blod og blodkomponenter til transfusjon. Opplæring og oppdatering av kompetanse er ivaretatt av blodbankene. Ledelsen ved blodbankene evaluerer jevnlig rutiner og retningslinjer ved blodbankene gjennom bruk av internrevisjoner etter oppsatt plan.
Helsetilsynet finner ikke grunnlag for å påpeke avvik for de undersøkte blodbankoppgavene som gjelder sykehusets rutiner for blodbestilling, pretransfusjonsundersøkelser, utstyr og reagenser og utlevering av blod og blodkomponenter samt sporbarhet.
Helsetilsynet vurderer at Ahus har opprettet systemer for håndtering av celler og vev, inkludert smittetesting av donorer av celler og vev, i tråd med kravene i forskrift om håndtering av celler og vev. Tilsynet viste at Ahus har utarbeidet prosedyrer og retningslinjer for disse områdene, og at kravene til opplæring og oppdatering av kompetanse blir etterlevd.
Helsetilsynet har ikke funnet grunnlag for avvik innen de reviderte områdene knyttet til håndtering av humane celler og vev inkludert smittetesting av donorer av celler og vev.
Med hilsen
Tone Andersen
seniorrådgiver
Ingerid Herstad Nygaard etter fullmakt
avdelingsdirektør
Brevet er godkjent elektronisk og sendes derfor uten underskrift
Saksbehandler: Tone Andersen, tlf. 21 52 99 73
Vedlegg:
Vedlegg 1 Gjennomføring av tilsynet
Vedlegg 2 Dokumentunderlag
Vedlegg 3 Program Ahus
Vedlegg 4 Deltakere på åpnings- og sluttmøte
Kopi til:
- Helsedirektoratet
- Statsforvalteren i Oslo og Viken
- Statens legemiddelverk
- Kontaktperson Akershus Universitetssykehus, seniorrådgiver Maj-Britt Aarnes Hvammen
[1] EDQM Guide to the quality and safety of tissues and cells for human application, 4th edition