Rapport etter tilsyn med håndtering av blod, blodkomponenter, celler og vev Martina Hansens Hospital 2023
Oppfølging av tilsynet
Ved dette tilsynet ble det avdekt lovbrudd. Kontakt etaten som har utført tilsynet for status på avviket.
Statens helsetilsyn har i perioden 22.mars – 4. september 2023 gjennomført tilsyn med Martina Hansens Hospital, heretter MHH. Tilsynet omfattet håndtering av blod, blodkomponenter, celler og vev og ble utført i henhold til følgende forskrifter:
- Forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev
Hensikten med tilsynet var å undersøke om ledelsen ved MHH sikrer et høyt beskyttelsesnivå for givere/donorer og mottakere, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Tilsynet ble gjennomført ved innhenting og gjennomgang av informasjon og dokumentasjon. I tillegg ble det gjennomført tilsynsbesøk med stikkprøver og møter med involvert personell og deres ledere. Tilsynsbesøket fant sted 1. og 2. juni 2023.
Tilsynet avdekket ett avvik:
MHH har fastsatt retningslinjer for validering av utstyr. Ved anskaffelse av fryser for oppbevaring av benvev ble retningslinjene ikke etterlevd. Mangelfull kontroll med at kravene til oppbevaringsbetingelser er oppfylt når nytt utstyr tas i bruk, kan gi økt risiko for at kvaliteten på humant benvev ikke blir opprettholdt.
1 Tilsynets tema og omfang
Statens helsetilsyn fører jevnlige tilsyn med håndtering av blod, blodkomponenter, celler og vev. Tilsynet gjennomføres etter helsetilsynsloven § 4, blodforskriften § 5-1 annet ledd og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Hensikten med tilsynet var å undersøke om ledelsen ved MHH sikrer et høyt beskyttelsesnivå for mottakere og givere/donorer, hindrer overføring av sykdom og trygger sikkerheten og kvaliteten på blod, blodkomponenter, celler og vev.
Vi har i dette tilsynet lagt hovedvekt på følgende:
- Håndtering av blod og blodkomponenter:
- Bestilling, pretransfusjonsundersøkelser herunder utstyr/reagenser.
- Valg og utlevering av blod og blodprodukter.
- Sporbarhet – mulighet til å identifisere blod og blodkomponenter fra giver til mottaker og omvendt.
- Håndtering av humane celler og vev, inkludert testing av donorer av celler og vev:
- Samsvar mellom sykehuset praksis og godkjenning etter forskrift om håndtering av humane celler og vev.
- Donasjon, uttak, konservering, oppbevaring, merking og prosessering av humant bein- og bruskvev beregnet på bruk til mennesker.
2 Aktuelt lovgrunnlag for tilsynet
2.1 Lovgrunnlag
Helsetilsynet er gitt myndighet til å kontrollere om virksomheter som håndterer blod, blodkomponenter, celler og vev etterlever gjeldende lov- og forskriftsbestemmelser.
Lovgrunnlag for tilsynet:
- Lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- Lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- Forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
- Forskrift om tapping, testing, prosessering, oppbevaring, distribusjon og utlevering av humant blod og blodkomponenter og behandling av helseopplysninger i blodgiverregistre (blodforskriften)
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
Blodforskriften og forskrift om håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i aktuell forskrift.
2.2 Nærmere om forsvarlighet
Det er et grunnleggende krav til helsetjenesten at den helsehjelpen som ytes er faglig forsvarlig.
Kravet om forsvarlighet er en rettslig standard. Dette innebærer at innholdet bestemmes med utgangspunkt i normer utenfor loven. Disse normene er forankret i anerkjent fagkunnskap, faglige retningslinjer og samfunnsetiske normer, og utgjør det som betegnes som god praksis. Samtidig danner normene utgangspunkt for å fastlegge hvor grensen mot det uforsvarlige går.
Kravet om forsvarlighet er også et krav om forsvarlig organisering av tjenesten. I dette ligger blant annet at det gjennomføres organisatoriske og systemmessige tiltak som gjør det mulig for helsepersonellet å oppfylle plikten til forsvarlig yrkesutøvelse. Det følger av dette at virksomheten må styre sin drift med siktemål om at tjenestene er i samsvar med god praksis.
Det er en nær sammenheng mellom kravet til forsvarlighet, kravet til internkontroll og systematisk arbeid for å ivareta pasientenes sikkerhet, jf. helsetilsynsloven § 3 og forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
2.3 Avvik og merknad
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Klassifisering av avvik:
- Kritisk avvik (K): Avvik som utgjør en signifikant risiko for skade på donor eller mottaker av blod, celler, vev og/eller organer.
- Stort avvik (S): Ikke kritisk avvik som utgjør en indirekte risiko for sikkerheten til donor og mottaker av blod, celler, vev og og/eller organer ved
- avvik fra gjeldende myndighetskrav for håndtering av blod, celler, vev og/eller organer
- svikt i prosedyrene for frigivelse av blod, celler, vev og/eller organer til bruk på mennesker, eller at ansvarlig person ikke har utført sine legale plikter
- manglende godkjenning fra Helsedirektoratet for aktuell aktivitet
En kombinasjon av flere mindre mangler som hver for seg ikke utgjør et stort avvik, men som til sammen utgjør et stort avvik, skal rapporteres som det.
- Andre avvik (A): Avvik som ikke kan klassifiseres som kritisk eller stort, men som innebærer manglende samsvar med kravene til god praksis som følger av forskriftene for håndtering av blod, celler, vev og/eller organer.
Merknad er forhold som ikke er i strid med krav fastsatt i eller i medhold av lov eller forskrift, men der tilsynsmyndigheten finner grunn til å påpeke mulighet for forbedring.
Rapporten omhandler forhold som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet.
3 Gjennomføring og deltakere ved tilsynet
3.1 Gjennomføring
Tidsrom for tilsynet, fra varsel ble sendt til ferdig rapport, var 22.mars – 4.september 2023.
For beskrivelse av hvordan tilsynet ble gjennomført og program for tilsynsbesøket se vedlegg 1 og 3.
3.2 Deltakere
Deltakere fra MHH:
- Kontaktperson fra virksomheten: Spesialrådgiver Elisabeth Duvaland.
- Oversikt over andre deltakere fremgår av vedlegg 3.
Deltakere fra Helsetilsynet:
- Seniorrådgiver Kristine Bjerkaas-Kjeldal (revisjonsleder).
- Seniorrådgiver Tone Andersen (revisor).
- Underdirektør Else Marie Pedersen (observatør).
4 Kort om virksomheten
Martina Hansens Hospital AS er et privat, ideelt sykehus innen ortopedi, revmatologi og revmakirurgi. Sykehuset er en del av det offentlige helsetilbudet gjennom driftsavtale med Helse Sør-Øst RHF.
5 Beskrivelse av faktagrunnlag – organisering av transfusjonsenheten ved MHH
Transfusjonsenheten ligger under laboratoriet ved MHH. Laboratoriet tilhører revmatologisk klinikk og avdelingssjef laboratoriet har det overordnede ansvaret (figur 1). Laboratoriet utfører blant annet blodtypeserologiske analyser og har ansvaret for sykehusets blodbankskap. MHH har inngått avtale om medisinskfaglig rådgiving i immunologi og transfusjonsmedisin og kjøp/salg av blodkomponenter med Vestre Viken HF.
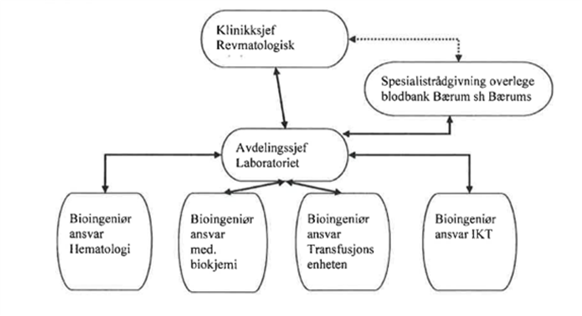
Figur 1: Illustrasjonsfoto over organisering av laboratoriet ved MHH som beskrevet i teksten ovenfor.
Tall for transfundert blod og blodkomponenter oppgitt av MHH for 2022:
|
|
SAG |
Plasma |
Trombocytter |
|---|---|---|---|
|
MHH |
94 |
19 |
1 |
5.1 Håndtering av blod og blodkomponenter ved MHH
5.1.1 Sykehusets egenkontroll
Laboratoriet har utført en egenkontroll i form av stikkprøver for utvalgte oppgaver innen immunhematologi jf. punkt 3.1, vedlegg 1. Helsetilsynet hadde på forhånd definert enkelte oppgaver som særlig kritiske for pasientsikkerheten og markert disse i egenkontrollskjemaet. Under tilsynsbesøket ble de ansatte intervjuet om praksis for disse oppgavene. Stikkprøvene omfattet kontroll og dokumentasjon for et utvalg utførte oppgaver ved
- blodbestilling
- pretransfusjonsundersøkelser, herunder utstyr og reagenser
- valg og utlevering av blod og blodkomponenter
Laboratoriet avdekket ett avvik ved egenkontrollen:
- Opplæring i ID-sikring ved prøvetakning kan ikke dokumenteres for prøvetaker.
På tidspunktet for tilsynsbesøket hadde laboratoriet ved MHH behandlet avviket og gjort følgende forbedringstiltak:
- Prosedyre for ID-sikring er lagt til i opplæringsprogrammet, og opplæringen dokumenteres gjennomført i Kompetanseportalen.
5.1.2 Identitetssikring ved blodprøvetaking til pretransfusjonsundersøkelser
Under tilsynsbesøket ble Helsetilsynet fortalt at alle blodprøver til pretransfusjonstesting på MHH blir tatt av personalet ved laboratoriet. Helsetilsynet fikk opplyst følgende vedrørende identitetssikring ved blodprøvetaking:
- Identitetssikring av pasienten utføres ved at prøvetaker spør om fullt navn og fødselsnummer og kontrollerer opplysningene mot identitetsopplysningene på medbrakt rekvisisjon eller etikett. Utført kontroll bekreftes ved at prøvetaker signerer etiketten på prøveglasset.
- Prøveglass uten signatur til pretransfusjonstesting:
- Signeringsliste sjekkes og prøvetaker må bekrefte at identiteten til pasienten er kontrollert.
- Hvis ikke prøvetaker kan bekrefte at identitetskontroll er utført avvises prøveglasset.
Sentrale regler
- Blodforskriften § 3-1 Krav til sporbarhet i blodbanker og transfusjonsenheter.
- Veileder for transfusjonstjenesten 11.1 Identitetssikring.
5.1.3 Blodbestilling og utlevering av blodprodukter
Laboratoriet ved MHH opplyste under tilsynet at avdelingene bestiller blod og blodprodukter elektronisk i laboratoriedatasystemet. Blod klargjort til pasienter legges i låst blodbankskap. Avdelingene har egne nøkler til blodbankskapet, henter selv blod og fyller ut dokumentasjonsliste «Uttak av blodprodukt til pasient.» Laboratoriet bestiller enheter med trombocytter og plasma til pasientene fra blodbanken ved Bærum sykehus. Enhetene blir levert direkte fra laboratoriet til aktuell avdeling.
Sentrale regler
- Blodforskriften § 3-12 Produktets integritet og kvalitet skal bevares ved utlevering
- Blodforskriften, vedlegg VI punkt 7 Oppbevaring og distribusjon
5.1.4 Kontroll av reagenser og utstyr
Under befaring på laboratoriet ble Helsetilsynet fortalt at screeningcellene blir kontrollert ved mottak. Kassetter og celler til ABO-typing blir kontrollert når de tas i bruk.
Kjølereagenser blir oppbevart ved anbefalt temperatur, og Helsetilsynet ble fortalt og fikk se dokumentasjon på at oppbevaringstemperaturen leses av daglig. Kassetter til ABO-typing og blodtypescreening skal etter leverandørens anbefaling, oppbevares i romtemperatur. Under tilsynsbesøket fikk Helsetilsynet se at MMH oppbevarer disse på lager uten temperaturkontroll. Blodbankskapet er tilkoblet sentralt driftsanlegg for overvåkning av temperatur. Ved temperatur utenfor oppsatte grenser, går melding til teknisk sjef, avdelingssjef og fagbioingeniør transfusjonsenheten.
Daglig, ukentlig og månedlig vedlikehold utføres etter oppsatt plan og dokumenteres. Periodisk vedlikehold (PV) og service etter feil blir utført av leverandør og Helsetilsynet ble forevist servicerapport for utført PV.
Sentrale regler
- Blodforskriften
- § 3-10 jf. vedlegg VI – punkt 4 Utstyr og materialer
Alt utstyr skal valideres, kalibreres og vedlikeholdes så det egner seg til tiltenkt formål.
5.1.5 Kvalitetssikring av de utførte analysene
Analysene som utføres på transfusjonsenheten kvalitetssikres ved bruk av interne og eksterne kvalitetskontroller. Vi ble fortalt og fikk se at interne kvalitetskontroller for blodtypeundersøkelser og antistoffscreening settes opp daglig og dokumenteres.
MHH deltar i det eksterne kvalitetssikringsprogrammet «Nasjonale kvalitetssikringsprogrammet av immunhematologiske analyser», tre ganger årlig. Helsetilsynet ble fortalt at de ansatte rullerer på å utføre de eksterne kvalitetskontrollene.
Sentrale regler
- Blodforskriften
- § 3-10 jf. vedlegg VI punkt 6.3 Laboratorieundersøkelser.
Kvaliteten til laboratorieundersøkelsene skal vurderes regelmessig ved for eksempel deltakelse i et eksternt kvalitetssikringsprogram.
5.1.6 Ledelse og kvalitetsforbedring
Helsetilsynet ble fortalt at laboratoriet ved MHH benytter Kompetanseportalen til å planlegge og dokumentere opplæring, vedlikehold og dokumentasjon av kompetanse.
Under tilsynsbesøket opplyste MHH at opplæringen i transfusjonsmedisin blir gitt av fagbioingeniør som er ansvarlig for transfusjonsenheten. Fagbioingeniør godkjenner gjennomført opplæring, men godkjenningen dokumenteres ikke. Personalet dokumenterer selv i kompetanseportalen at de har gjennomført opplæring.
Utarbeidete prosedyrer for transfusjonsenheten har en gyldighet på to år, og ligger i elektronisk kvalitetshåndbok, EK. Fagbioingeniør er ansvarlig for oppdatering av prosedyrene, og avdelingssjef må godkjenne endringene i EK. Ved endringer i prosedyrer får personalet et varsel i kompetanseportalen om at prosedyrene må leses på nytt. Endringer i prosedyrene blir tatt opp på personalmøter.
Helsetilsynet ble fortalt og vist følgende under tilsynsbesøket:
- Avvik meldes, håndteres og tas opp på felles møte.
- Validering av nytt utstyr utføres før det tas i bruk.
- Internrevisjon blir utført etter oppsatt plan og vi har mottatt revisjonsrapport fra 2021.
- Ledelsens gjennomgang (LG), utføres årlig og laboratoriet rapporterer til ledergruppen på MHH.
Sentrale regler
- Blodforskriften
- § 2-3 stiller krav om at oppgaver kun utføres av personale som har fått tilstrekkelig opplæring og er kvalifisert til det, jf. vedlegg VI.
- § 2-4 fastsetter at blodbanker og transfusjonsenheter skal etablere internkontroll for å sikre at virksomheten planlegges, organiseres, utføres og vedlikeholdes i samsvar med regler fastsatt i lov og forskrift. Internkontrollen skal tilpasses virksomhetens art, aktiviteter, størrelse og risikoforhold i det omfang som er nødvendig for å etterleve kravene, samt de standarder og spesifikasjoner til et kvalitetsstyringssystem som følger av vedlegg VI. Internkontrollen skal dokumenteres.
6 Beskrivelse av faktagrunnlag – håndtering av humant benvev
MHH håndterer humant benvev til bruk på mennesker. Aktiviteten er lagt til benvevsbanken og er organisert under én av fire kirurgiske seksjoner ved ortopedisk klinikk. Klinikken har ingen akuttfunksjon, og benvev blir høstet i forbindelse med planlagt hoftekirurgi.
6.1 Håndtering av benvev
Helsetilsynet ble under tilsynsbesøket fortalt og fikk beskrevet følgende rutiner for sporbarhet og dokumentasjon knyttet til håndtering av benvev:
- MHH har godkjenning for donasjon, uttak, konservering, oppbevaring, merking og prosessering av humant ben- og bruskvev beregnet på bruk til mennesker.
- Seksjonsoverlege, seksjon for hoftekirurgi, er medisinsk ansvarlig og ansvarshavende for benvevsbanken.
- Benvevsbanken benytter kompetanseportalen til planlegging og dokumentasjon av opplæring og vedlikehold av kompetanse.
- Avdelingssykepleier operasjon er ansvarlig for drift og oppfølging av benvevsbanken, samt opplæring av sykepleiere.
- Seksjonsoverlege hofte har ansvar for opplæring av legene. Helsetilsynet ble vist en presentasjon med informasjon om drift og prosedyrer for benvevsbanken som benyttes ved internundervisning.
- Det benyttes et manuelt system for dokumentasjon av sporbarhetsopplysninger og smittetester. Det utføres månedlig gjennomgang av lagerbeholdning og oppdatering av benvevsbankliste. Helsetilsynet fikk se prosedyre: «Benbank – Benvevsbankliste. Lårbenshode/caput femoris», som benyttes ved telling av lagerbeholdningen av lårbenshoder.
- MHH utførte internrevisjon ved benvevsbanken i 2023, og Helsetilsynet har mottatt revisjonsrapporten.
- Avvik meldes og håndteres i EK og blir tatt opp på avdelingsmøter.
- Årsrapport for 2022 er utarbeidet og sendt Helsedirektoratet.
- Benvevsbanken leverer årsrapport til ledergruppen ved MHH ved ledelsens gjennomgang.
6.2 Uttak og bruk av donorben
Helsetilsynet fikk vist og beskrevet følgende rutiner for høsting av donorben:
- Benvevsbanken innhenter samtykke fra donor.
- Ferdigkodet donasjonsskjema fra perm merket «Karantene» og skjema «Benbank – innhold benvevbank Lårbenshode/caput femoris» blir fylt ut med donors navn og fødselsnummer og lagres i denne permen.
- Høstet caput pakkes i doble sterile bokser og ytterboksen blir merket med koden fra donasjonsskjema, samt dato for høsting. Batchlapp fra benboksen settes inn i donasjonskjemaet.
- Boksen med høstet caput legges i fryser ved - 80 °C, i hylle merket «karantene».
- Ved høsting av lårbenshode tas det en benbit og penselprøve som sendes til mikrobiologisk avdeling ved Bærum sykehus for bakteriologisk testing.
- Blodprøver til virustesting blir tatt av donor dagen før donasjon og etter seks måneder.
- Når svar fra begge virustestene og svar fra bakteriologiske tester foreligger, signerer både benvevsbankansvarlig avdelingssykepleier operasjon, og en operasjonssykepleier for klarering av lårbenshode.
- Boksen med lårbenshodet flyttes til hylle for frigitt bein i fryser og tilhørende dokumenter flyttes til perm «Frigitte.»
- Når lårbenshodet blir transplantert til pasient, fylles mottakers navn og fødselsnummer inn i skjema «Benbank – Innhold benvevsbank Lårbenshode/caput femoris.» Dokumenter og tilhørende dokumentasjon flyttes over i perm «Transplanterte caput femoris.»

Figur 2: Viser permer med sporbarhetsdokumentasjon for lårbenshoder som er i karantene, frigitt, transplantert eller kassert.
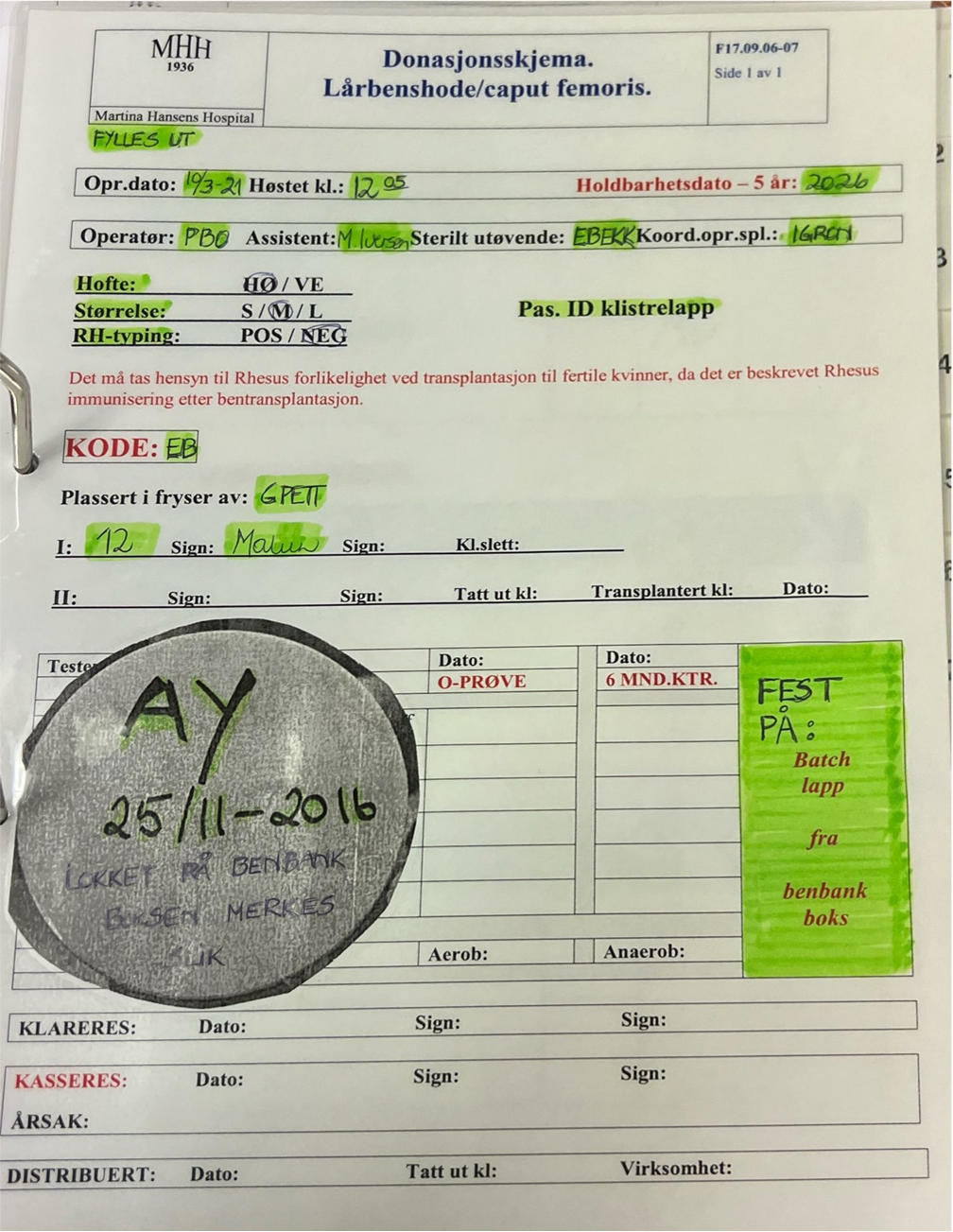
Figur 3: Oversikt over donasjonsskjema som fylles ut ved donasjon av lårbenshode.
6.3 Oppbevaring av donorben - ultrafryser
Under tilsynsbesøket ble Helsetilsynet fortalt at benvevsbanken tok i bruk ny fryser for oppbevaring av benvev i 2021. Fryseren har integrert alarm og temperaturen blir kontinuerlig registrert via sentralt driftsanlegg. For å sikre forsvarlig drift av benbankfryseren har MHH utarbeidet prosedyren «Benbank- Havari/ for høy temperatur i Thermo Forma ultradypfryser». På dagtid går alarm til benbankansvarlig og på ettermiddag/kveld til teknisk avdeling. Vi fikk se at fryseren er låst og står inne på område med adgangskontroll. Vi ble fortalt at fryserens filter støvsuges ukentlig av renholder og dette dokumenteres. Øvrig vedlikehold utføres av leverandør. MHH kunne ikke fremlegge valideringsrapport for fryseren.
Sentrale regler:
- Forskrift om håndtering av humane celler og vev
- § 3-10 generelle krav til utstyr mv. Nytt og reparert utstyr skal testes når det installeres, og valideres før bruk.
- § 11 krav til kritisk utstyr. Alt kritisk utstyr og tekniske apparater skal være identifisert og validert, samt jevnlig inspisert og vedlikeholdt
7 Helsetilsynets vurdering og konklusjon
I dette kapittelet redegjør vi for våre vurderinger. Faktagrunnlaget med sentrale krav som stilles til MHH ved håndtering av blod, blodkomponenter og benvev ved laboratoriet og benbanken er beskrevet i kapitel 5 og 6.
MHH har etablert prosedyrer og retningslinjer for å håndtere blod og blodkomponenter til transfusjon. Prosedyrene inkluderer opplæring og oppdatering av kompetanse. Helsetilsynet vurderer at retningslinjene er tilstrekkelige, og at sykehuset følger opp aktiviteten gjennom eksempelvis avvikshåndtering og internrevisjoner.
MHH har utarbeidet prosedyrer og retningslinjer for håndtering av benvev. Helsetilsynet anser at kravene til opplæring og oppdatering av kompetanse blir oppfylt innenfor de undersøkte områdene. Videre vurderer vi at sykehusets manuelle system for sporbarhetsdokumentasjon er tilstrekkelig ut fra størrelsen på benvevsbanken. Ledelsen ved MHH gjennomfører internrevisjoner for å evaluere aktiviteten på benvevsbanken.
Forskrift om kvalitet og sikkerhet ved håndtering av humane celler og vev, stiller krav til at nytt eller reparert utstyr skal valideres før bruk. Videre må kritiske målefunksjoner kalibreres jevnlig, og testresultatene skal dokumenteres. Disse bestemmelsene gjelder også for frysere som brukes til oppbevaring av humant benvev. I 2021 anskaffet MHH en ny fryser for oppbevaring av humant benvev. Sykehuset har i egen prosedyre beskrevet temperaturgrenser og overvåkning av fryseren. Sykehuset validerte imidlertid ikke oppbevaringstemperatur og alarmfunksjon for benvevsfryseren ved installasjon.
7.1 Avvik – oppbevaring av humane celler og vev
Avvik:
MHH har fastsatt retningslinjer for validering av utstyr. Ved anskaffelse av fryser for oppbevaring av benvev ble retningslinjene ikke etterlevd. Mangelfull kontroll med at kravene til oppbevaringsbetingelser er oppfylt når nytt utstyr tas i bruk, kan gi økt risiko for at kvaliteten på humant benvev ikke blir opprettholdt. (A)
Avvik fra følgende krav i forskrift om krav til kvalitet ved håndtering av humane celler og vev:
- §10 Generelle krav til utstyr
- §11 Krav til kritisk utstyr
7.2 Merknad relatert til håndtering av blod og blodkomponenter
Helsetilsynet avdekket ikke forhold ved sykehusets håndtering av blod og blodkomponenter for transfusjon som vi anser som avvik fra lov og forskrift. Vi har funnet grunnlag for å komme med to anbefalinger.
Merknader:
MHH har ansvaret for at reagenser til blodtypeserologi oppbevares ved anbefalt temperatur fra leverandør, også ved oppbevaring ved romtemperatur. Helsetilsynet anbefaler at sykehuset også kontrollerer og overvåker at romtemperaturen er innenfor leverandørens definerte grenser.
MHH benytter kompetanseportalen til dokumentasjon av opplæring. Leder godkjenner opplæringen for hver enkelt ansatt. Helsetilsynet anbefaler at leders godkjenning blir dokumentert i portalen.
8 Forventninger til virksomheten og videre oppfølging
Etter tilsyn der det påpektes avvik har ledelsen ved virksomheten ansvar for å iverksette og følge opp korrigerende tiltak.
Helsetilsynet har etter tilsynsbesøket mottatt tilbakemelding fra Martina Hansens Hospital med beskrivelse av korrigerende strakstiltak etter det påpekte avviket.
Vi ber om at valideringsrapport etter validering av fryser blir sendt oss sammen med Martina Hansens valideringsplan av ultrafryser innen 2. oktober 2023.
Med hilsen
Ingerid Herstad Nygaard etter fullmakt
avdelingsdirektør
Kristine Bjerkaas-Kjeldal
seniorrådgiver
Saksbehandler: Kristine Bjerkaas-Kjeldal
Vedlegg:
- Gjennomføring av tilsynet
- Dokumentunderlag
- Program
- Deltakerliste
Kopi til:
- Helsedirektoratet
- Statens legemiddelverk
- Statsforvalteren i Oslo og Viken