Rapport etter tilsyn ved IVF-klinikken Oslo AS Håndtering av egg, sæd og embryo beregnet for assistert befruktning 2018
Oppfølging av tilsynet
Ved dette tilsynet ble det konstatert avvik fra lov eller forskrift. Tilsynsmyndigheten har vurdert de tiltakene som er satt i verk som tilstrekkelige. Tilsynet er derfor avsluttet.
Sammendrag
Statens helsetilsyn har gjennomført tilsyn ved IVF-klinikken Oslo AS, heretter kalt IVF-klinikken. Tilsynet omfattet håndtering av egg, sæd og embryo beregnet for assistert befruktning, og ble utført i henhold til følgende forskrift:
- Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev
Formålet med tilsynet var å undersøke om IVF-klinikken sikrer et høyt beskyttelsesnivå for par i forbindelse med fertilitetsbehandling, hindrer overføring av smitte og trygger sikkerheten og kvaliteten på egg, sæd og embryo.
Helsetilsynet har lagt hovedvekt på å undersøke om IVF-klinikken følger opp og vedlikeholder sine systemer for å etterleve kravene i forskriften faglig og styringsmessig.
Tilsynet ble utført som en kombinasjon av informasjons- og dokumentinnhenting, og tilsynsbesøk med stikkprøver.
Tilsynet avdekket to avvik:
Avvik 1:
IVF-klinikken Oslo AS kontrollerer luftkvaliteten i IVF laboratoriet jevnlig, men ledelsen følger ikke i tilstrekkelig grad opp at tiltak for å opprettholde et lavt antall partikler og mikroorganismer mellom kontrollmålingene blir etterlevd i praksis.
Avvik 2:
IVF-klinikken Oslo AS har ikke etablert rutiner for sikker identifisering av par som kommer til fertilitetsbehandling.
Dato: 19. februar 2018
Elisabeth Try Valø
revisjonsleder
Tone Blørstad
revisor
1. Innledning
Helsetilsynet fører jevnlige tilsyn med håndtering av celler og vev. Tilsynet gjennomføres etter lov om statlig tilsyn med helse- og omsorgstjenesten § 1 og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev § 56.
Formålet med tilsynet var å vurdere om IVF-klinikken sikrer et høyt beskyttelsesnivå for par i forbindelse med fertilitetsbehandling, hindrer overføring av smitte og trygger sikkerheten og kvaliteten på egg, sæd og embryo.
Rapporten er utarbeidet etter tilsyn ved IVF-klinikken. Tilsynet ble utført etter regelverket listet opp i kapittel 2 Regelverk. Varsel om tilsyn ble sendt 22. september 2017 og endelig rapport ferdigstilt 19. februar 2018.
2. Regelverk
- lov om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven)
- lov om statlig tilsyn med helse- og omsorgstjenesten m.m. (helsetilsynsloven)
- forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev (forskrift om håndtering av humane celler og vev)
- forskrift om ledelse og kvalitetsforbedring i helse- og omsorgstjenesten (forskrift om ledelse og kvalitetsforbedring i helsetjenesten)
De aktuelle forskriftene er hjemlet i flere ulike lover. Der det er relevant har vi valgt å hjemle avvik direkte i forskriften.
Forskrift om kvalitet og sikkerhet ved håndtering av humane celler og vev har egne bestemmelser om internkontroll. Disse kommer i tillegg til, og utfyller de generelle bestemmelsene i forskrift om ledelse og kvalitetsforbedring i helsetjenesten.
3. Hva tilsynet omfattet
Helsetilsynet har undersøkt om IVF-klinikken følger opp og vedlikeholder sine systemer faglig og styringsmessig for å etterleve kravene i forskrift om håndtering av humane celler og vev. Vi har undersøkt klinikkens aktivitet med utgangspunkt i følgende oppgaver:
- oppbevaring av egg, sæd og embryo
- sporbarhet – mulighet til å identifisere egg, sæd og embryo fra donor til mottaker og omvendt
- hindring av sykdomsoverføring via egg, sæd og embryo
- sporbarhet – mulighet til å finne tilbake til opprinnelse og detaljer for produkter og materialer som kommer i kontakt med egg, sæd og embryo
Vi har vurdert hvordan ledelsen følger opp aktiviteten som er omfattet av dette tilsynet med vekt på:
- opplæring og kompetanse
- skriftlige prosedyrer
- avvikssystemer og meldeordninger
- jevnlig og systematisk gjennomgang av aktiviteten ved for eksempel interne revisjoner og ledelsens gjennomgang
Selve pasientbehandlingen ved assistert befruktning er ikke en del av dette tilsynet.
Avvik er mangel på oppfyllelse av krav gitt i eller i medhold av lov eller forskrift.
Klassifisering av avvik:
- Kritisk avvik (K): Avvik som utgjør en signifikant risiko for skade på donor eller mottaker av celler og vev.
- Stort avvik (S): Ikke kritisk avvik som utgjør en indirekte risiko for sikkerheten til donor og mottaker av celler og vev ved:
o avvik fra gjeldende myndighetskrav for håndtering av celler og vev
o svikt i prosedyrene for frigivelse av celler og vev til bruk på mennesker, eller at ansvarlig person ikke har utført sine legale plikter
o manglende godkjenning fra Helsedirektoratet for aktuell aktivitet
En kombinasjon av flere mindre mangler som hver for seg ikke utgjør et stort avvik, men som til sammen utgjør et stort avvik, skal rapporteres som det. - Andre avvik (A): Avvik som ikke kan klassifiseres som kritisk eller stort, men som innebærer manglende samsvar med kravene til god praksis som følger av forskriften for håndtering av celler og vev.
Rapporten omhandler forhold som er avdekket under tilsynet og gir derfor ingen fullstendig tilstandsvurdering av virksomhetens arbeid innenfor de områder tilsynet omfattet.
4. Beskrivelse av virksomheten - spesielle forhold
IVF-klinikken i Oslo ble som første private «prøverørsklinikk» etablert i 1986 på Ring medisinske senter, nå Volvat medisinske senter. I 2014 ble klinikken kjøpt opp av IVF Sverige AB, og holder i dag til i lokaler på Majorstua.
IVF Sverige AB er et konsern bestående av åtte IVF-klinikker i Sverige, Island og Norge, og forskningsenheten IVF Research Sweden AB. Forskningsenheten koordinerer forskningsarbeid ved de respektive klinikkene.
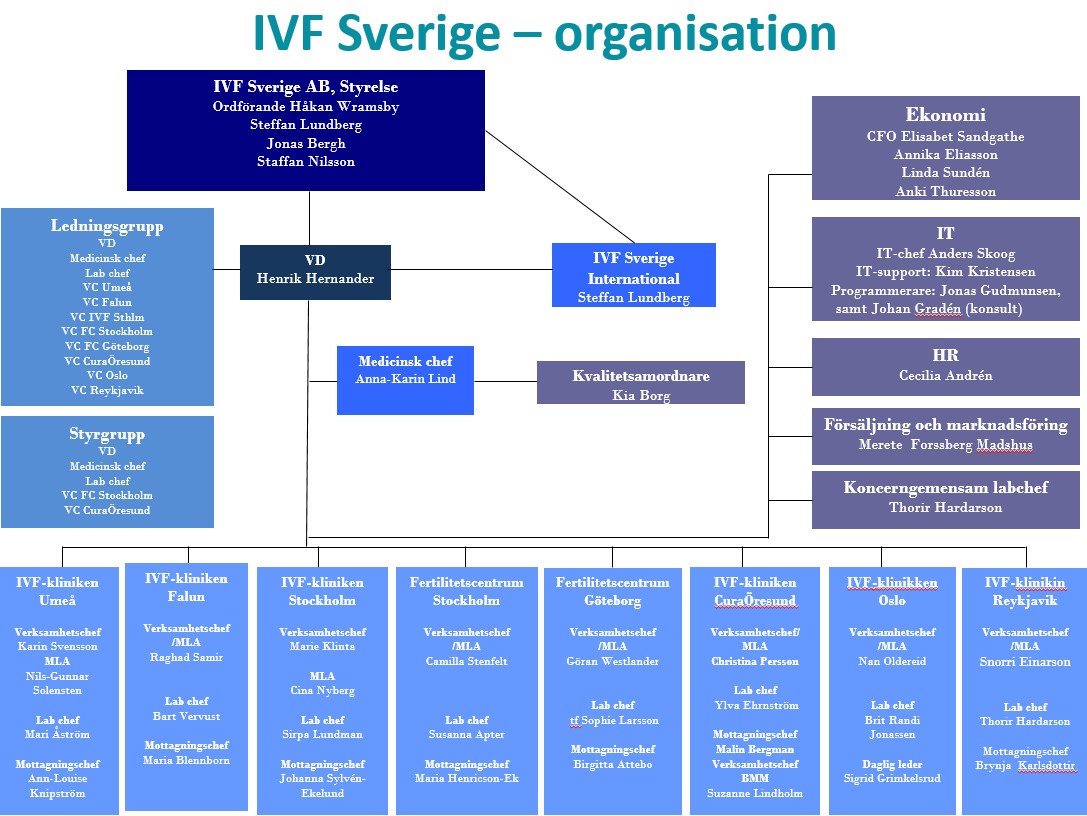
Klinikken i Oslo har godkjenning fra Helsedirektoratet etter bioteknologiloven og forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev for fertilitetsbehandlingen som tilbys i Norge. Godkjenningene omfatter assistert befruktning med partnersæd og donorsæd, kirurgisk uthenting av sæd fra bitestikkel/testikkel, prøverørsbehandling og befruktning ved hjelp av mikroinjeksjon. Klinikken har også godkjenning for import av donorsæd og for bruk av vitrifiserte befruktede og ubefruktede egg til assistert befruktning.
5. Gjennomføring av tilsynet
Tilsynet ble gjennomført ved hjelp av informasjons- og dokumentinnhenting, og tilsynsbesøk med stikkprøver.
- Varsel om tilsyn ble sendt til IVF-klinikken Oslo AS 22. september 2017.
Tilsynet ble varslet som et dokumenttilsyn med mulighet for å utvide til også å inkludere et tilsynsbesøk.
Varselbrevet inkluderte et egenrapportskjema for tilbakemelding om klinikkens aktiviteter knyttet til håndtering av egg, sæd og embryo.
- Gjennomgang og vurdering av dokumenter.
Oversikt over dokumenter Helsetilsynet har gjennomgått i forbindelse med tilsynet er gitt i kapittel 8, Dokumentunderlag.
Etter gjennomgang av tilsendt egenrapportskjema med vedlegg ble det besluttet at tilsynet også skulle inkludere et tilsynsbesøk. Bakgrunnen for beslutningen var at både leder for laboratoriet, daglig leder og klinikksjef/ansvarlig person etter forskriften var endret siden forrige tilsyn.
- Tilsynsbesøk ble gjennomført 11. januar 2018 i IVF-klinikkens lokaler på Majorstua i Oslo. Tilsynsbesøket omfattet:
- åpningsmøte
- intervju med involvert personell og befaring i lokalene
- sluttmøte med presentasjon av Helsetilsynets funn
Gjennomgang av pasientdokumentasjon var satt inn i programmet, men ble ikke gjennomført grunnet prioritering av intervjuer og befaring.
6. Helsetilsynets funn
Avvik 1:
IVF-klinikken Oslo AS kontrollerer luftkvaliteten i IVF laboratoriet jevnlig, men ledelsen følger ikke i tilstrekkelig grad opp at tiltak for å opprettholde et lavt antall partikler og mikroorganismer mellom kontrollmålingene blir etterlevd i praksis. (A)
Avvik fra følgende krav i forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev:
§ 8 Internkontroll mv
§ 12 Anlegg og lokaler
§ 33 Prosedyrer ved prosessering
Avviket bygger på følgende:
Klinikken er del av et svensk konsern, og viser til et styrende dokument for laboratoriemiljø og infrastruktur. Prosedyren legger blant annet vekt på følgende tiltak for å opprettholde god luftkvalitet:
- Ringer, mobiltelefoner, armbåndsur og tilsvarende skal ikke benyttes på laboratoriet.
- All håndtering av papir på laboratoriet skal minimeres.
I tillegg har IVF-klinikken utarbeidet en «Klinikinstruktion» for «Hygiene kontroll - Partikkeltelling og CFU». Klinikken utfører kontrollmålinger som angitt i instruksjonen:
- Partikkeltelling skal gjennomføres minst en gang i året og skal gjennomføres under aktivitet.
- Bakteriemålinger (CFU – colony forming units) skal gjennomføres to ganger i året.
Under tilsynsbesøket ble følgende observert:
- Laboratoriet fremstod som rotete med mange unødvendige støvsamlende gjenstander, eksempelvis tidsskrifter, bilder, ledninger og kjøleskapsmagneter.
- Klinikkens skriftlige prosedyrer og retningslinjer ble i liten grad benyttet i praksis. Under tilsynsbesøket var klinikken i en overgangsfase mellom to ulike elektroniske dokumentsystemer, og for enkelte dokumenter var det uklart hvilke som var gjeldende og i hvilket system de var lagret.
- Den svenske konsernledelsen gjennomfører internrevisjoner ved alle klinikkene etter det styrende dokumentet «Interna revisjonar». I dokumentet står det at «Revisionernas syfte/hensikt är att avgöra hur väl vårt ledningssystem överensstämmer med krav fastställda av ISO 9001 och eventuellt ISO 14000 eller ISO 15189 (om ackrediterat lab)». I dokumentet står det også at «Alla kliniker gjenomgår minst en revision per år».
Forbedringspunkter etter internrevisjon ved klinikken i Oslo i 2016 refererer til NS EN ISO 9001-2015. Det fremgår ikke i rapporten om luftkvaliteten har vært et tema, eller om etterlevelse av kravene i forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev har vært vurdert. Planlagt internrevisjon i 2017 ble opplyst å være utsatt fordi revisor ble forhindret fra å reise til Norge.
Avvik 2:
IVF-klinikken Oslo AS har ikke etablert rutiner for sikker identifisering av par som kommer til fertilitetsbehandling. (A)
Avvik fra følgende krav i forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev:
§ 8 Internkontroll mv
§ 29 Opplysninger i pasientjournal
Avviket bygger på følgende:
Forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev krever at virksomheter skal dokumentere «hvordan og av hvem donor er sikkert identifisert». Det svenske konsernet har rutiner for at par må forvise legitimasjon ved oppmøte i forbindelse med behandling, eller elektronisk ved bank-id/mobil-id.
Under tilsynsbesøket ble følgende observert:
- Ved registrering av partene i et par som kommer til IVF-klinikken for behandling, ber klinikken paret om å identifisere seg ved å oppgi navn og fødselsnummer (11 sifre). Klinikken dokumenterer ikke hvordan og av hvem paret er sikkert identifisert.
- I dokumentet «Informasjon før egguttak» står det at par som skal møte til fertilitetsbehandling ved IVF-klinikken Oslo skal «ta med legitimasjon». I praksis blir ikke par som kommer til fertilitetsbehandling ved IVF-klinikken bedt om å forevise legitimasjon.
- Konsernledelsen gjennomfører internrevisjoner ved alle klinikkene etter det styrende dokumentet «Interna revisjonar». I dokumentet står det at «Revisionernas syfte/hensikt är att avgöra hur väl vårt ledningssystem överensstämmer med krav fastställda av ISO 9001 och eventuellt ISO 14000 eller ISO 15189 (om ackrediterat lab)». I dokumentet står det også at «Alla kliniker gjenomgår minst en revision per år».
Ett av forbedringspunktene etter Internrevisjon gjennomført i 2016 er at ID-kontroll mot legitimasjon bør gjøres jf. «ISO 9001-2015 Omr. 8.2». Det fremgår ikke i rapporten om kravene til sikker og dokumentert identitetskontroll i forskrift om krav til kvalitet og sikkerhet ved håndtering av humane celler og vev har vært vurdert. Planlagt internrevisjon i 2017 ble opplyst å være utsatt fordi revisor ble forhindret fra å reise til Norge.
7. Vurdering av klinikkens styringssystem
Av hensyn til sikkerheten til par som mottar fertilitetsbehandling er minstekravet til håndtering av egg, sæd og embryo utdypet i forskrift om håndtering av humane celler og vev. Forskriften har egne bestemmelser om ledelse og kvalitetsforbedring og stiller strenge krav til at virksomhetene systematisk følger opp egen aktivitet.
IVF-klinikken Oslo ble kjøpt opp av IVF Sverige AB i 2014. Oppkjøpet har medført endringer ved blant annet rutiner og elektroniske systemer ved klinikken. De planlagte endringene var ved tidspunktet for tilsynsbesøket ikke sluttført. I samme periode har klinikken også ansatt nye ledere.
Beskyttelsesnivået for par under behandling skal være like høyt uavhengig av hvem som er eier og hvilke endringer klinikken gjennomgår. Helsetilsynet anser at det er av avgjørende betydning at de ansatte ved klinikken til enhver tid vet hvilke prosedyrer som gjelder, og hvor disse er lagret. Prosedyrer og praksis må være i samsvar med det norske regelverket.
IVF Sverige AB skal årlig gjennomføre internrevisjon ved klinikken i Oslo. Helsetilsynet vil presisere at internrevisjoner må inkludere kontroll med at krav gitt i forskrift om håndtering av humane celler og vev etterleves. Vi vil også påpeke at ledelsen ved klinikken må sørge for at funn fra revisjoner følges opp og tiltak iverksettes.
8. Dokumentunderlag og korrespondanse
For dokumentunderlag i forbindelse med tilsynet viser vi til vedlegg 1. Dokumentunderlaget er delt inn i to kategorier:
- dokumentasjon knyttet til klinikkens daglige drift og andre forhold av betydning som ble oversendt under forberedelsen av tilsynsbesøket
- dokumentasjon som ble mottatt under tilsynsbesøket
Korrespondanse mellom IVF-klinikken og Helsetilsynet:
- e-postkommunikasjon mellom klinikksjef Nan Birgitte Oldereid ved IVF-klinikken og seniorrådgiver Elisabeth Try Valø fra Helsetilsynet vedrørende praktisk gjennomføring av tilsynet.
9. Program og deltakere ved tilsynsbesøket
For program og oversikt over deltakere fra virksomheten viser vi til følgende vedlegg:
- vedlegg 2, program for tilsynsbesøket
- vedlegg 3, deltagere under tilsynsbesøket
Fra tilsynsmyndigheten deltok:
seniorrådgiver Elisabeth Try Valø (revisjonsleder)
seniorrådgiver Tone Blørstad (revisor)
avdelingsdirektør Børge Tomter (observatør)